合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
-
> 芬兰Kibron表面张力测试仪跟踪氯乙烯悬浮聚合中的表面张力变化情况
> 泡沫是怎么形成的?表面张力如何影响泡沫的稳定性
> 糖基阳离子型双子表面活性剂复配酸化压裂用助排剂,可降低表面张力、快速返排
> W/O型Pickering乳液油水间的界面张力对乳液稳定性的影响
> 水、常温液态金属等9种流体对液滴碰撞壁面影响的数值研究(三)
> 无机粒子对TPAE界面张力、发泡、抗收缩行为的影响(三)
> 烷基糖苷柠檬酸单酯二钠盐水溶液的动态表面张力测定及影响因素(上)
> 0.01mg是什么精度的天平?超微量天平的称重范围
> 新型悬滴实验系统的研制与二甲基亚砜/甲醇混合物表面张力测量(二)
> Delta-8 动物胃肠道体内中药物的溶解度的测定——结果和讨论
推荐新闻Info
-
> 4种新型稀土双酞酞菁衍生物合成及LB膜的制备
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(四)
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(三)
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(二)
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(一)
> 新型多羟基苯磺酸盐驱油剂的界面张力优化及油田应用潜力分析(三)
> 新型多羟基苯磺酸盐驱油剂的界面张力优化及油田应用潜力分析(二)
> 新型多羟基苯磺酸盐驱油剂的界面张力优化及油田应用潜力分析(一)
> 基于最大气泡压力方法测量液态锂锡合金表面张力
> 烷基糖苷表面活性剂界面张力与润湿性相关性研究(二)
不同温度下手性离子液体及二元混合物的密度和表面张力(下)
来源:河北科技师范学院学报 浏览 1365 次 发布时间:2024-10-29
2.2[bm im][L-lactate]的表面性质
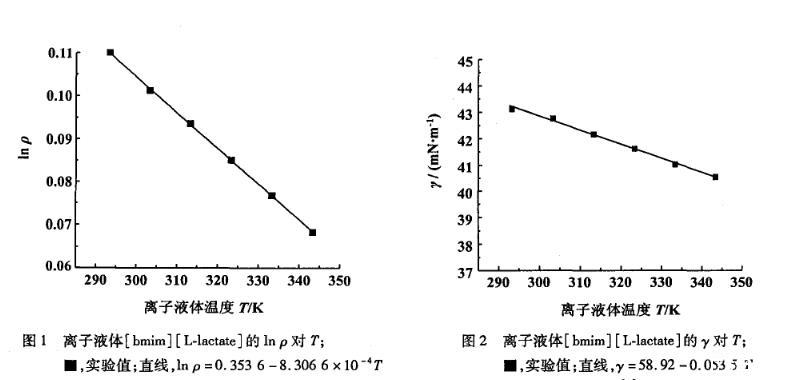
在293.15~343.15 K温度范围内实验测得的离子液体[bmim][L-lactate]的表面张力值随温度的升高而减小(图2),并且得到表面张力的经验方程:
式中γ为离子液体的表面张力(单位:mN·m-1),T为离子液体温度(单位:K),a=58.92,b=0.053 5,相关系数为0.998 0。表面熵可由式(6)的斜率得到Ss=b=-(∂γ/∂T)P,而表面焓在293.15~343.15 K温度范围内为常数Hs=a=γ-T(∂γ/∂T)P。[bmim][L-lactate]的表面熵为0.053 5 m J·(K·m2)-1,表面焓为58.92 mJ·m-2。

离子液体的临界温度(critical temperatures,Tc)是其重要的物理化学性质之一,然而离子液体本身的性质使得临界温度的实验值很难获得。因此,许多研究小组应用Guggenheim经验方程来推测离子液体的临界温度。该经验方程的形式为:
式中Tc为离子液体的临界温度(单位:K),T为离子液体温度(单位:K),γ为表面张力(单位:mN·m-1),K为经验常数。该方程说明临界温度下表面张力值为0。由式(7)估算的[bmim][L-lactate]的临界温度为1 169 K,比[emim][L-lactate]的临界温度高。Rebelo等提出离子液体沸点温度可由Tb=0.6 Tc估算得到。计算得到的[bmim][L-lactate]的沸点温度为701 K。
离子液体的独特性质之一是其具有低蒸汽压,这可以用蒸发焓来体现。Zaitsau等提出了一个经验方程可用来估算蒸发焓:
2.3[bm im][L-lactate]+H2O二元混合物的体积性质
不同浓度下,实验测得的二元混合体系[bmim][L-lactate]+H2O在不同温度下的密度值随温度的增加而减小(图3);随着体系中离子液体摩尔分数的增加而增大;离子液体浓度低时密度增加较快,离子液体浓度高时密度增加缓慢。
在二元混合物中,过量摩尔体积对研究分子聚集的特性是非常重要的。过量摩尔体积VE可由下试得到:
式中VE为过量摩尔体积(单位:cm3·mol-1),xIL为二元混合物中[bmim][L-lactate]的摩尔分率;ρ,ρ1,ρ2分别为混合物、纯离子液体[bmim][L-lactate]和H2O的密度(单位:g·cm-3);M1和M2分别为[bmim][L-lactate]和H2O的摩尔质量(单位:g·mol-1)。二元混合物的过量性质应用Redlich-Kister方程进行拟合:
式中Z代表过量性质,xIL为二元混合物中[bmim][L-lactate]的摩尔分率,BP代表拟合参数,M为多项式的项数,采用Marquardt算法进行优化。拟合参数BP值和标准偏差(σ)列于表1。标准偏差由下式计算得到:
式中zexp,zcal和ndat分别代表实验值、计算值和实验次数。

表1二元混合物[bmim][L-lactate]+H2O的V E的拟合参数BP和均方偏差(σ)
在全摩尔浓度范围内,过量摩尔体积VE均为正值(图4)。当xIL<0.4时,VE随着离子液体[bmim][L-lactate]浓度的增加而增加,并在xIL=0.4处取得最大值,分别为1.10,0.92,0.72 cm3·mol-1;然后VE随着[bmim][L-lactate]浓度的增加而减小,在离子液体高浓度区域和水的高浓度区域之间出现了峰值。这种现象与[emim][BF4]+H2O和[bmim][BF4]+H2O相似。VE的正值说明与理想混合相比具有正的偏差,并且温度越低,VE值越正。以上说明了在混合的过程中水分子减弱甚至破坏了离子液体阴阳离子间的强相互作用。
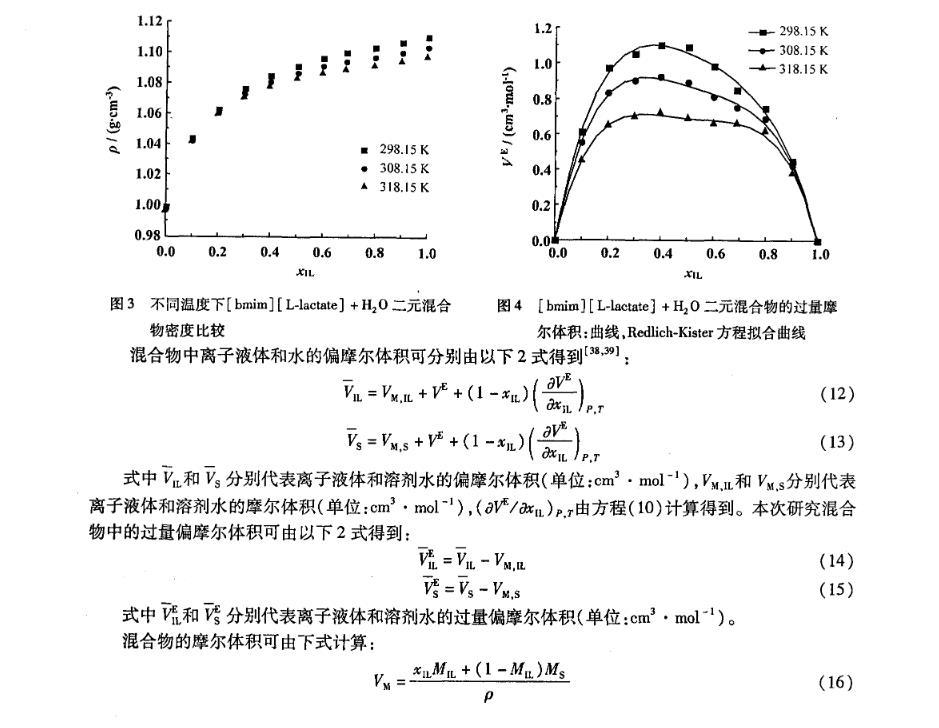
图3不同温度下[bmim][L-lactate]+H2 O二元混合物密度比较
图4[bmim][L-lactate]+H2 O二元混合物的过量摩尔体积:曲线,Redlich-Kister方程拟合曲线
混合物中离子液体和水的偏摩尔体积可分别由以下2式得到:
式中VM为混合物的摩尔体积(单位:cm3·mol-1),MIL和MS分别为离子液体和溶剂水的摩尔质量(单位:g·mol-1),xIL为离子液体在混合物中的摩尔分率,ρ为混合物的密度(单位:g·cm-3)。
二元混合物中组份i的表观摩尔体积Vφi可由下式计算得到:
式中VM代表混合物的摩尔体积(单位:cm3·mol-1),xi代表组分i在混合物中的摩尔分率,VMj代表另一个组分j的摩尔体积(单位:cm3·mol-1)。结合式(9)和(17)可以得到本次研究混合物中的表观摩尔体积:
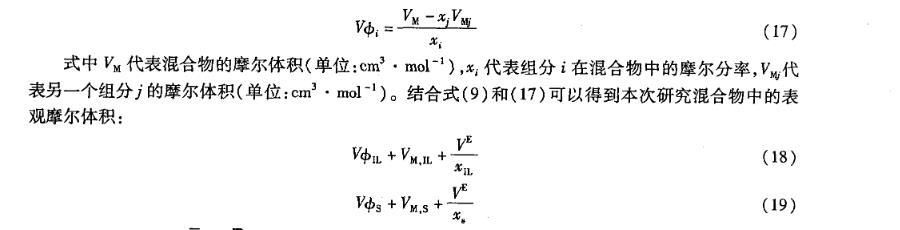
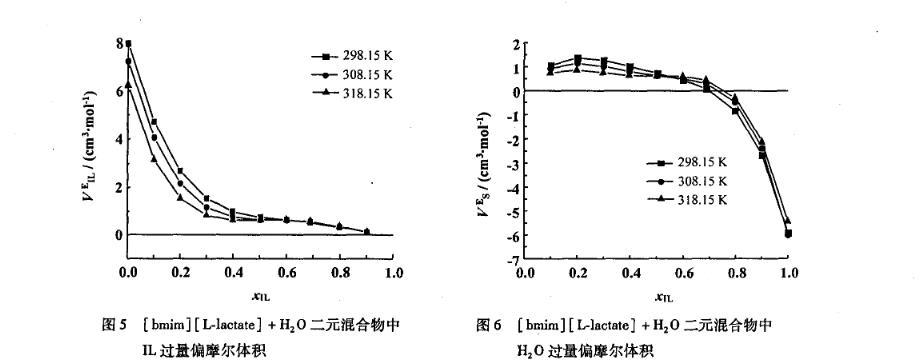
图5[bmim][L-lactate]+H2 O二元混合物中IL过量偏摩尔体积
图6[bmim][L-lactate]+H2O二元混合物中H2 O过量偏摩尔体积
离子液体和水的二元混合物中,离子液体的表现偏摩尔体积VφIL随着温度的升高而增大,并且在全摩尔浓度范围内随着离子液体浓度的增加而减小(图8);而水的表现偏摩尔体积VφS随着温度的升高而减小(图9),并且与VφIL具有相反的变化趋势。
2.4[bm im][L-lactate]+H2O二元混合物的表面性质
不同浓度下,实验测得的二元混合体系[bmim][L-lactate]+H2O在不同温度下的表面张力见图10。表面张力偏差δγ可由下试得到:

式中γ和γi分表示混合物和组分i的表面张力(单位:mN·m-1),xi代表组分i的摩尔分率。可以看出,[bmim][L-lactate]+H2O二元混合物的表面张力偏差在全摩尔浓度范围内为负值。温度升高,混合物的表面张力值减小(图10)。在离子液体摩尔浓度低时(xIL<0.06),混合物的表面张力随着xIL的增加快速减小;而在高离子液体浓度区域,表面张力值几乎为一常数。说明[bmim][L-lactate]在水溶液中的行为接近表面活性剂,相似的性质出现在[emim][BF4],[bmim][BF4]和[hmim][BF4]的水溶液中。而这个拐点(xIL≈0.06)称为聚集点(aggregation onset,AO)。[bmim][L-lactate]+H2O二元混合物的临界聚集浓度(critical aggregation concentration,CAC)为2.06 mol/L,比[emim][L-lactate]+H2O二元混合物的临界聚集浓度(1.96 mol/L)要高。
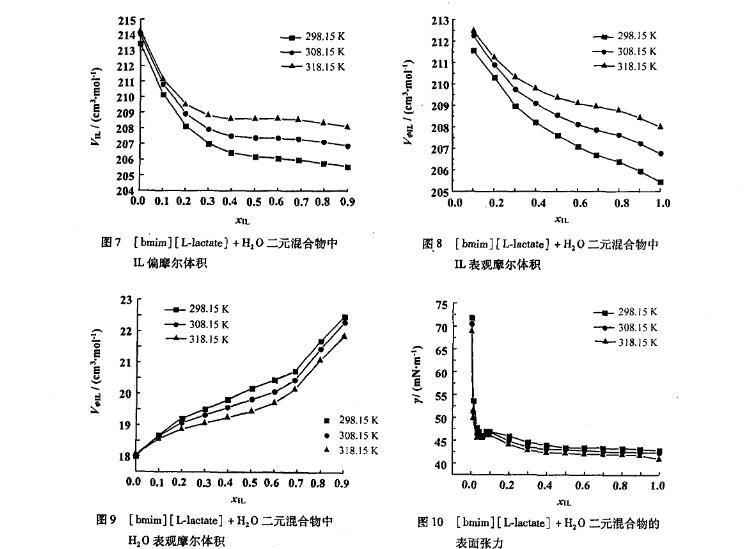
图7[bmim][L-lactate]+H2O二元混合物中IL偏摩尔体积
图8[bmim][L-lactate]+H2 O二元混合物中IL表观摩尔体积
图9[bmim][L-lactate]+H2O二元混合物中H2 O表观摩尔体积
图10[bmim][L-lactate]+H2 O二元混合物的表面张力
混合物的表面张力偏差(δγ)可以根据下式进行拟合

拟合参数和均方偏差见表2。
表2二元混合物[bmim][L-lactate]+H2 O拟合参数和均方偏差(σ)
3结论
本次研究测定了不同温度下手性离子液体[bmim][L-lactate]以及二元混合物[bmim][L-lactate]+H2O的密度和表面张力。结果表明,离子液体的密度和表面张力均随着温度的增加而减小;并且对纯离子液体的热膨胀系数、表面熵、表面焓以及其临界温度进行了计算。研究了二元混合物的体积性质(过量摩尔体积、偏摩尔体积、表观摩尔体积、过量偏摩尔体积)、表面性质,发现二元混合物的密度随温度的增加而减小;所研究的二元混合体系的密度均随着体系中离子液体摩尔分数的增加而增大;混合物中手性离子液体与分子溶剂间具有强的相互作用。










