合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
-
> 液体表界面张力测试的注意事项
> 嗜热链球菌发酵乳对全蛋液起泡性、pH、黏度、表面张力的影响(二)
> 聚氧乙烯链长度调控非离子Gemini表面活性剂的表面张力、接触角(一)
> 煤矿井下活性磁化水降尘机制及技术研究
> 2022年中国表面活性剂行业全景产业链、重点企业经营情况及发展趋势
> 表面张力仪测试预热具体方法
> 防治剑麻介壳虫病,推荐剂量下药剂的表面张力值多少最佳
> 弹簧秤测量水的表面张力系数实验装置改进措施及效果
> 3种增效剂对灭草松AS、草铵膦AS、高效氟吡甲禾灵EC增效作用及表面张力影响(一)
> 含氟聚氨酯超疏水涂层表面性能、化学稳定性、耐摩擦性能研究——结果与讨论、结论
推荐新闻Info
-
> 不同矿浆浓度、粒度、伴生矿物、捕收剂和起泡剂对矿浆表面张力的影响(三)
> 不同矿浆浓度、粒度、伴生矿物、捕收剂和起泡剂对矿浆表面张力的影响(二)
> 不同矿浆浓度、粒度、伴生矿物、捕收剂和起泡剂对矿浆表面张力的影响(一)
> 长庆油田陇东地区的CQZP-1助排剂表/界面张力测量及现场应用(三)
> 长庆油田陇东地区的CQZP-1助排剂表/界面张力测量及现场应用(二)
> 长庆油田陇东地区的CQZP-1助排剂表/界面张力测量及现场应用(一)
> 液膜断裂点与电压最大值在表面张力测量中的对比研究(二)
> 液膜断裂点与电压最大值在表面张力测量中的对比研究(一)
> 表面张力与表面张力系数测量:概念、方法与科学意义
> 微重力下二极对非均匀旋转磁场控制半浮区液桥表面张力对流的数值研究(下)
基于表面张力的开放式微流体平台,利用微柱重建三维肺部细胞微环境
来源: BioChip Journal 生物芯片期刊 浏览 1075 次 发布时间:2024-11-19
人类的肺部由气管、支气管和肺泡组成,这些部分是氧气和养分向人体运输的重要交换界面。肺部容易发展气道疾病,因此对其的研究和建模需求日益增加。器官芯片作为一种模拟体外器官细胞微环境的工具,具有成本、伦理、时间和性能等方面的优势,但制造过程需要整合和选择复杂的细胞类型、细胞外基质成分和生物制造过程。当前,仅有少数体外微流体平台能再现肺泡的体内尺寸,且未考虑在气道炎症中起重要作用的肺成纤维细胞。传统的聚二甲基硅氧烷(PDMS)微流体平台存在低通量和小分子吸附等性能缺陷,限制了大规模生产的可扩展性和整合性。
3D打印为解决这些问题提供了一种解决方案,它提供了与常规PDMS芯片相同的生物性能和生物降解性,同时实现了高通量和无小分子吸附。然而,3D打印的分辨率尚未与软光刻技术相媲美,且使用固化树脂无法模拟呼吸运动。近期,某些由昂贵材料制成的设备已经能够实现几微米厚度的肺泡所需尺寸,并复制单个肺泡的体内上皮面积,还能模拟呼吸运动。但这些设备不是一次性使用的,在高通量和广泛应用方面存在不足。因此,仍需进一步研究和改进,以创建更准确、现实和稳健的肺芯片模型。
研究内容
图1展示了一个基于表面张力的开放式微流体平台的结构和液体图案化过程,用于再现肺部的三维细胞微环境。图1a展示了微流体平台的顶视图和侧视图。平台的中心区域包含微柱阵列,用于形成薄的水凝胶膜,两侧是包含不同细胞悬浮液的流体通道。图1b展示了水凝胶和不同细胞层的位置安排,模拟肺部细胞环境的气-液界面结构。图1c到图1e展示了图案化过程的两个关键步骤——液体注入和保持。首先,水凝胶液体通过微柱流动;当液体达到通道的扩展区域时,使用吸取器将多余液体移除,剩余部分被保持在微柱之间形成所需的薄层。这一过程中利用了表面张力的“毛细钉扎”现象,即通过几何结构和表面特性来控制液体的流动和停留。
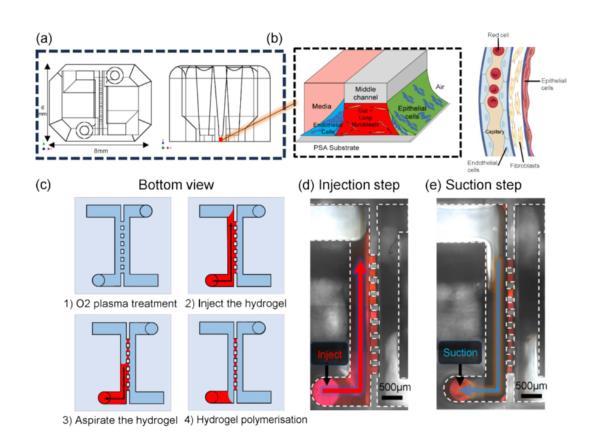
图1微流控芯片和液体图案化过程
图2展示了用于模拟液体填充和图案化条件的数值模拟和实验验证,进一步分析了在微流体平台中实现毛细钉扎过程的成功条件。图2a展示了与图案化成功条件相关的物理参数,包括柱子的高度、间距和侧通道的长度。通过这些参数的控制,可以预测液体在微柱之间的保留情况。图2b展示了液体填充过程的数值模拟,包括在不同接触角(例如60°和120°)条件下的液体流动和钉扎效果。模拟结果显示了如何通过改变接触角和压力控制液体在微柱之间的流动和停留。图2b的模拟验证了在较大接触角下液体被钉扎在微柱边缘的效果。图2c至2e总结了不同微柱高度、间距和侧通道长度对液体保留过程的影响,通过这些参数优化可实现液体在微柱之间的稳定钉扎,适用于后续的细胞培养实验。
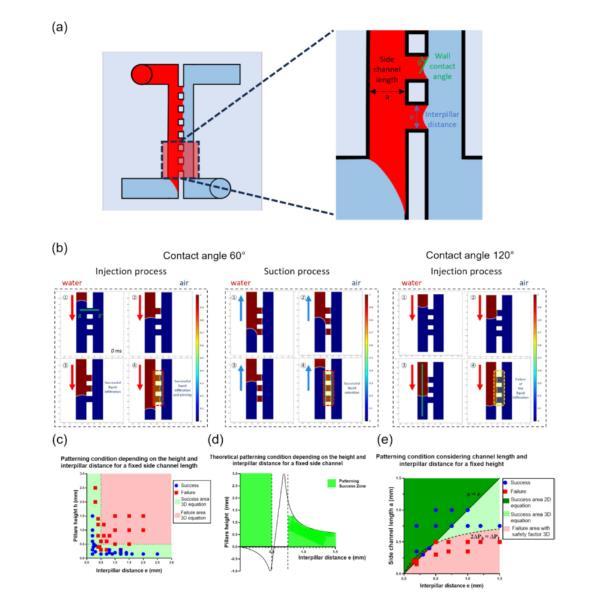
图2数值模拟与图案化条件
图3通过细胞加载流程示意图和荧光图像,展示了微流体平台在再现肺泡三维微环境方面的有效性。图3a展示了细胞加载的步骤,包括在水凝胶薄膜两侧加入不同类型的细胞,以创建多层细胞结构。图3b和3c展示了微流体平台上与内皮细胞和肺成纤维细胞的共培养荧光图像。水凝胶薄膜中含有橙色染色的成纤维细胞,水凝胶膜侧面绿色层表示生长的内皮细胞层。这种结构模拟了肺部的基质和内皮层,为后续肺部疾病研究提供了生理相关的模型。图3d和3e分别展示了细胞配置的示意图和最大投影的共聚焦显微图像。在这些图中可以看到肺成纤维细胞(橙色)和内皮细胞(绿色)在水凝胶薄膜的不同层次的分布情况,形成了一个三维的细胞共培养环境。图像还显示,细胞在培养过程中保持了较高的活力,并成功地在水凝胶薄膜周围形成了均匀的细胞层。

图3芯片的共培养和三培养
总结与展望
在这项研究中展示了3D打印和毛细钉固着作为制造高通量微流体设备的有效工具的潜力。结果表明,工程化一个薄的水凝胶层以模拟气-液界面的大小是可行的,这个大小接近100-150微米,适合细胞培养,并具有多种细胞图案配置,便于共聚焦成像。未来的工作可以包括开发一个完整的双细胞层模型,其中包括癌细胞,或使用空气泵模拟设备内的呼吸。这种微流体平台提供了一系列广泛的未来应用,例如粉末吸入实验或药物筛选。










