合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 烷基糖苷表面活性剂界面张力与润湿性相关性研究(二)
> 烷基糖苷表面活性剂界面张力与润湿性相关性研究(一)
> 嵌段比例对温敏聚合物表面张力的影响及临界胶束浓度分析(五)
> 嵌段比例对温敏聚合物表面张力的影响及临界胶束浓度分析(四)
> 利用表面张力优化浮选工艺:调整剂AY在石英-胶磷矿分离中的活性调控(二)
> 利用表面张力优化浮选工艺:调整剂AY在石英-胶磷矿分离中的活性调控(一)
> 嵌段比例对温敏聚合物表面张力的影响及临界胶束浓度分析(三)
> 嵌段比例对温敏聚合物表面张力的影响及临界胶束浓度分析(二)
> 嵌段比例对温敏聚合物表面张力的影响及临界胶束浓度分析(一)
> 温度和碳碳双键数对脂肪酸酯表面张力的影响(二)
不动杆菌菌株XH-2产生物表面活性剂发酵条件、性质、成分研究(二)
来源:化学与生物工程 浏览 916 次 发布时间:2024-12-23
1.3生物表面活性剂的特性分析
1.3.1生物表面活性剂的制备
将菌株XH-2在优化后的培养基中发酵培养60h,经纱布初过滤的发酵液在4℃、10 000r·min-1下离心20min,取上清液用6mol·L-1HCl溶液调节pH值至2.0,用等体积的乙酸乙酯溶液萃取2次,合并有机相于旋转蒸发仪上浓缩,将浓缩液倒入烧杯中,待自然挥发干后即得生物表面活性剂粗品。
1.3.2生物表面活性剂对温度、pH值和盐度的耐受性
将生物表面活性剂粗品配制成浓度为0.3g·L-1的溶液,分别在4℃、室温、60℃、100℃条件下处理30min,冷却至室温,测定其表面张力。
用1mol·L-1HCl溶液或1mol·L-1NaOH溶液调节生物表面活性剂溶液的pH值分别为2、4、6、8、10、12,均于室温下放置12h,测定其表面张力。
加入适量氯化钠使生物表面活性剂溶液的盐度分别为0%、1%、3%、5%、7%、9%,均于室温下放置12h,测定其表面张力。
1.3.3临界胶束浓度(CMC)的测定
用蒸馏水将生物表面活性剂粗品配制成不同浓度的溶液,在室温下测定其表面张力。根据生物表面活性剂浓度与表面张力的变化曲线图得出临界胶束浓度。
1.3.4生物表面活性剂成分的初步鉴定
表面活性剂的鉴定:采用亚甲基蓝-氯仿实验。将生物表面活性剂粗品配制成浓度为0.3 g·L-1的溶液,取5 mL表面活性剂溶液,依次加入10 mL亚甲基蓝和5 mL氯仿,充分混匀,静置几分钟后观察其颜色。若氯仿层颜色变深,而水层几乎无色,表明样品属于阴离子型表面活性剂;若水层颜色变深,而氯仿层几乎无色,表明样品属于阳离子型表面活性剂;若两层颜色大致相同,且水层呈乳液状,表明样品属于非离子型表面活性剂。
定性分析:将生物表面活性剂粗品配制成一定浓度的溶液,用1 mol·L-1HCl溶液调节pH值到2左右,于4℃静置过夜,观察现象。若产生白色沉淀,表明其为脂肽或脂蛋白类表面活性剂;若没有白色沉淀产生,表明其为糖脂类表面活性剂。
红外光谱(FTIR)分析:将生物表面活性剂粗品用KBr压片法进行红外光谱分析。
2结果与讨论
2.1不同碳、氮源对菌株XH-2产生物表面活性剂的影响(图1)
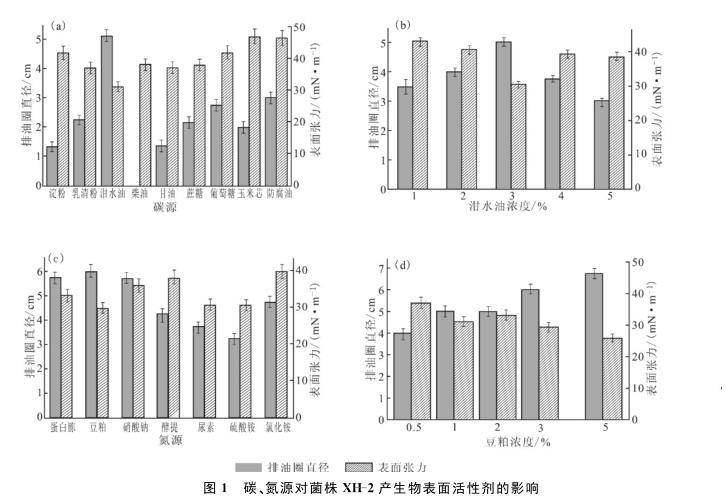
图1碳、氮源对菌株XH-2产生物表面活性剂的影响
由图1a可知,菌株XH-2以柴油为碳源时,发酵液的排油圈直径为0;以泔水油为碳源时,排油圈直径最大(5.1 cm),相对应的表面张力最小(31.1 mN·m-1)。相较于葡萄糖、淀粉、甘油这些常用碳源,泔水油用作产生物表面活性剂的原料尚未见报道。以泔水油为原料生产生物表面活性剂,既能废物利用,又节能环保,具有显著的现实意义。由图1b可知,当泔水油浓度为3%时,表面张力最小(30.49 mN·m-1),排油圈直径最大(4.8 cm)。因此,确定最适碳源为3%泔水油。
由图1c可知,以豆粕为氮源时,发酵液的表面张力最小(29.69 mN·m-1),相对应的排油圈直径最大(6.1 cm);当采用无机氮源尿素和硫酸铵时,虽然发酵液的表面张力较小,分别为30.62 mN·m-1和30.56 mN·m-1,但相对应的排油圈直径也小,分别为3.75 cm和3.25 cm。已有利用无机氮源(如氯化铵、硝酸钠等)进行发酵生产生物表面活性剂的相关报道,而在本研究中最适的氮源是豆粕。由图1d可知,随着豆粕浓度的增大,排油圈直径增大,在豆粕浓度为5%时,排油圈直径达到最大(6.75 cm),表面张力最小(25.83 mN·m-1)。因此,确定最适氮源为5%豆粕。
2.2最佳接种量、盐度、初始pH值的确定(图2)
接种量影响微生物所产生物表面活性剂的产量。接种量过大,培养液中细菌的初始浓度高,过量的菌体在生长过程中因消耗大量的营养底物而使生物表面活性剂的产量降低;接种量过小,培养液中菌体浓度低,培养周期延长。由图2a可知,在接种量为4%时,表面张力最小(30.39 mN·m-1),相对应的排油圈直径最大(5.25 cm);接种量超过4%后,表面张力增大。因此,确定最佳接种量为4%。
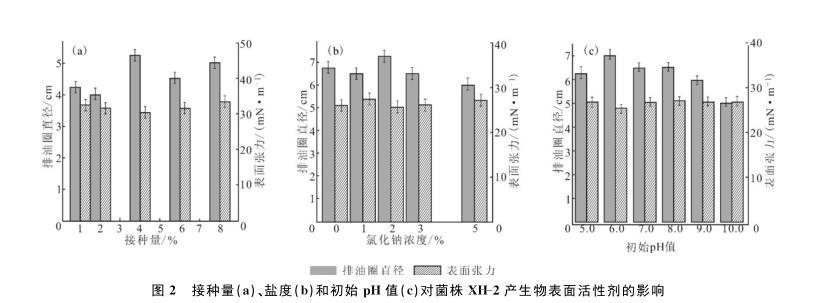
图2接种量(a)、盐度(b)和初始pH值(c)对菌株XH-2产生物表面活性剂的影响
盐度调节细胞内外的渗透压,影响微生物的新陈代谢和酶的活性,盐度过高或过低都会对微生物的新陈代谢产生不利影响。由图2b可知,盐度为2%时,表面张力最小(25.75 mN·m-1),排油圈直径最大(7.25 cm);而盐度低于或高于2%时,发酵液的表面张力增大,排油圈直径减小。因此,确定菌株XH-2产生物表面活性剂的最适盐度为2%。
微生物的生命代谢活动与环境的pH值密切相关。微生物机体内的生物化学反应一般是酶促反应,参与反应的酶都有其相应的最适pH值范围,一般认为pH值6.5~8.5有利于微生物产生物表面活性剂。由图2c可知,菌株XH-2在初始pH值5.0~10.0范围内,其表面张力基本上是先减小后增大。当初始pH值为6.0时,发酵液的排油圈直径最大(7.1 cm),表面张力最小(25.25 mN·m-1);当初始pH值为10.0时,发酵液的排油圈直径最小(5.2 cm),表面张力为26.91 mN·m-1。因此,确定菌株XH-2产生物表面活性剂发酵培养基的最适初始pH值为6.0。










