合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 烷基二苯醚/烷基苯混合磺酸盐静态表面张力、金属腐蚀性及净洗力测定(二)
> 烷基二苯醚/烷基苯混合磺酸盐静态表面张力、金属腐蚀性及净洗力测定(一)
> 全自动张力测定仪揭示子细胞表面张力对胞质分裂结局的主导作用(二)
> 全自动张力测定仪揭示子细胞表面张力对胞质分裂结局的主导作用(一)
> 烟道气与正己烷对稠油表面张力的影响机制研究(三)
> 烟道气与正己烷对稠油表面张力的影响机制研究(二)
> 烟道气与正己烷对稠油表面张力的影响机制研究(一)
> 变化磁场、零磁场条件下磁性液体表面张力系数测定
> 晶圆级超平整石墨烯载网的批量化制备步骤与应用
> 水性不锈钢喇叭网抗划涂料的技术突破与性能优化
可拉伸复合单层电极用于低压电介质执行器——实验部分
来源:上海谓载 浏览 2109 次 发布时间:2021-12-17
2.实验部分
2.1.化学制品
区域正聚(3-己基噻吩-2,5-二酰基)(P3HT,CAS 156074-98-5,纯度为99.995%)和区域正聚(3-癸基噻吩-2,5-二酰基)(P3DT,CAS 110851-65-5,纯度为99.995%)由Sigma Aldrich订购并按收货时使用。多壁碳纳米管(MWCNT;外径15–35 nm,长度≥10μm)从Nanothinx S.A.(希腊里约热内卢)购买。聚(丙烯酸)(PAA,25%溶于水,CAS 9003-01-4)从Chemie Brunschwig订购。乙醇(99.9%)和氯仿(99.2%)从VWR Prolabo Chemicals订购。PDMS(Sylgard 186,MED-4086)和PDMS溶剂(OS-2)从道康宁(密歇根州奥本)订购。
2.2.LS法制备DEA电极
2.2.1.聚噻吩(PT)溶液
PT(P3DT或P3HT)溶液(0.167g/L)在氯仿-乙醇9:1 v/v中制备,然后超声处理30分钟
2.2.2.多壁碳纳米管/铂混合溶液
将PT溶解在氯仿溶液(0.167 g/L)中,然后超声处理30 min。将多壁碳纳米管分散在乙醇(20 g/L)中,然后超声处理1 h。将两种溶液以9(氯仿)/1(乙醇)的体积分数混合,然后超声处理5 h,然后在3000 rpm下离心15 min。收集上清液并进行两次额外的离心,每次离心15分钟。根据光学显微镜图像和补充数据(第1节,图S1和表S1)中概述的LS转移复合MWCNT/PT单层的表面电阻值,对该工艺进行了优化。
2.2.3.单层电极制作
单分子膜在KIBRON-Langmuir-Blodgett(LB)槽(MicroTroughX)中形成。使用微型注射器在超纯水表面(18.2 MΩcm Millipore Simplity,Billerica,MA)上喷洒足够体积的溶液。溶剂蒸发后,单层以10 mm/min的势垒速度压缩,并记录表面压力。在下文中,等温线表示为槽面积的函数,而不是每个单体的面积。通过布鲁斯特角显微镜原位验证气道-水界面的单层均匀性;补充数据(第2节)[31]中给出了有关该技术的更多详细信息。对于LS转移,单层保持在15 mN/m的表面压力下,并使用KIBRON的步进电机以2 mm/min的速度向单层水平移动PDMS基板。一旦基底/单层接触建立,PDMS基底升高,直到转移完成。
2.3.原子力显微镜(AFM)
使用Rosset等人[32]报告的方法制备100μm厚的PDMS膜,并将其用作单层电极LS转移的基底(补充数据,第3.1节)。AFM图像采用Brüker公司的尺寸图标显微镜的峰值力敲击模式进行。使用弹簧常数为0.4 Nm的ScanAsyst空气悬臂梁(Brüker)在空气中进行AFM成像−1.在0.5 Hz扫描频率下,以高度模式和256×256分辨率获得10μm×10μm图像。使用NanoScope软件版本1.40(Brüker)进行数据处理。
2.4.表面电阻测量
将转移到100μm厚PDMS基底上的单分子膜放置在两个矩形铜电极上,围绕一个1cm×1cm正方形作为活性区。通过在铜电极之间施加10V的测量电流确定电阻。使用Gamry Instruments恒电位仪(参考600)进行这些测量。
2.4.1.随时间变化的表面电阻稳定性
研究了PT掺杂对表面电阻稳定性的影响。将转移的PT单分子膜浸入乙腈中的0.15 M FeCl3中5分钟,然后用乙腈冲洗[29]。对于每种类型的单层,测量六个单独的样品,以获得平均值和标准偏差。
2.4.2.作为应变函数的表面电阻
在不同的拉伸条件下,测量了转移到100μm厚PDMS悬浮基底上的单分子膜的表面电阻。在每种情况下使用两个样品,拉伸过程中采用1%拉长/s的速度。还研究了样品循环对表面电阻的影响。为此,每个样品使用10个拉伸释放周期(1%/s),每个周期之间延迟30秒。
2.5.单分子膜杨氏模量的测量
单层电极的杨氏模量通过使用单轴拉伸试验装置的拉伸试验进行测量。通过测量极软的10μm厚PDMS基底(杨氏模量为40 kPa)上单层的硬化冲击,可以计算单层的杨氏模量(关于PDMS制备的更多详细信息,见补充数据,第3.2节)。使用直线电机(Saia Burgess的UAL)以0.67%/s的应变速率对PDMS膜进行单轴循环拉伸(20%应变)。拉伸方向平行于PDMS矩形的2 mm边缘,因此拉伸的PDMS膜处于纯剪应力状态。在测量过程中,使用力传感器(Futek LSB200,容量100 mN)和步进电机编码器同时测量力和样品伸长率,从而能够表示应力-应变关系。在整个实验过程中,编写了LabVIEW代码来控制电机和力传感器。
测量裸PDMS膜的杨氏模量后,将单层电极转移到这些PDMS膜上。使用与裸PDMS膜相同的参数测定PDMS+电极双层的杨氏模量。PDMS+电极双层由两个长度和宽度相等的粘附层形成,因此使用[33]计算电极杨氏模量:

其中Y是杨氏模量,t是厚度。
2.6.DEAs制造
制备了2.0μm厚的PDMS膜(Sylgard 186,道康宁)作为DEA的DE膜(PDMS膜制造的详细信息见补充数据,第3.3节)。为了处理和预拉伸亚微米悬浮PDMS膜,开发了一种可拉伸支架,该支架由丙烯酸粘合剂(3M,VHB 4905)制成,上面覆盖有硅转移粘合剂(粘合剂研究,ARclear 8932)。使用可拉伸支架,从PET基材上释放2.0μm厚的悬浮PDMS膜,并以1.2的线性比等双轴预拉伸至1.4μm厚(图2a)。使用硅酮转移粘合剂将预拉伸的PDMS固定在聚甲基丙烯酸甲酯(PMMA)支架(图2b)上。将掩模(由硅粘合剂的背膜ARclear 8932制成)放置在悬浮的PDM上(图2c)。掩膜用于通过LS转移形成单层图案,并保持悬浮PDMS膜平坦(图2d)。在单层电极的LS转移后,在掩模和PDMS层之间沉积一滴乙醇以帮助剥离掩模。获得了一侧带有图案化单层电极的预拉伸PDMS薄膜(图2e)。将带有一个转移电极的PDMS膜涂敷在较小的支架上,PDMS裸露表面朝上(图2f)。在这个较小的支架上,第一个图案化电极与铜连接接触(图2g),第二个电极在另一侧转移(图2c-e)。使用硅酮转移粘合剂将另一个较小的保持环粘合到DEA,以提供第二电极的电接触(图2h)。使用少量导电银环氧树脂确保单层电极和铜带之间的良好电气连接(参见补充数据,第4节,图S3)。DEA的活性区(直径3mm的循环)位于预拉伸的1.4μm厚PDMS膜的中心,两个电极重叠。
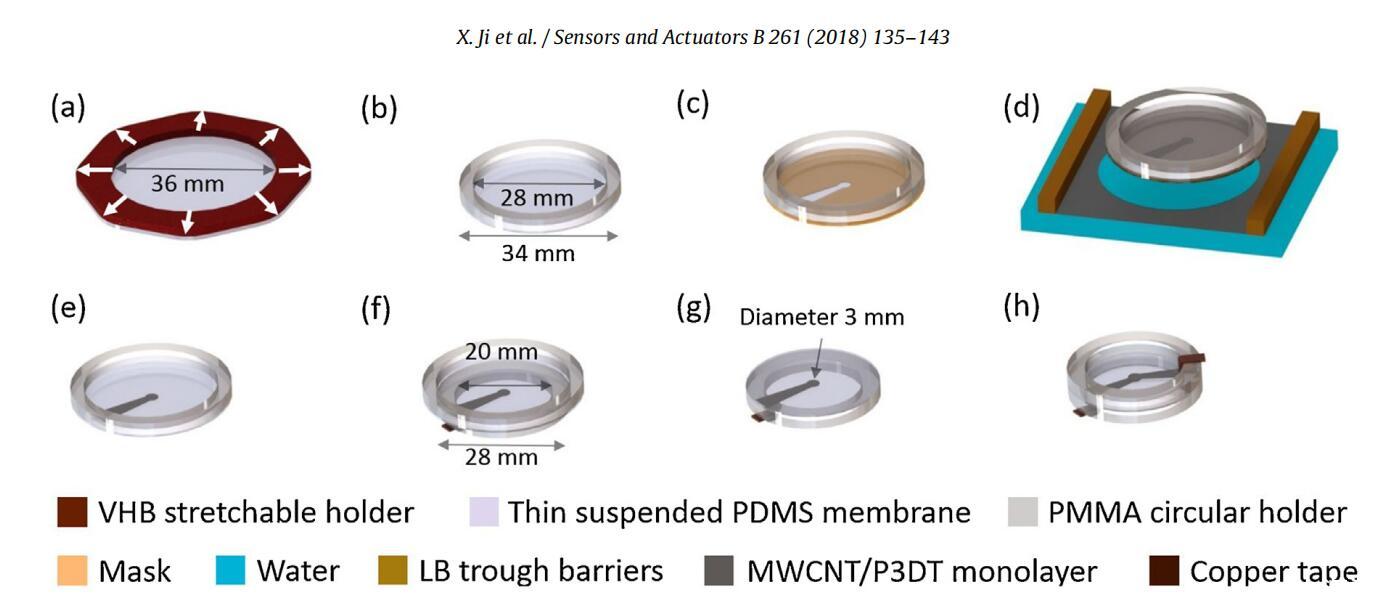
图2。采用LS技术制备1.4μm厚DEA的工艺。(a)悬浮式PDM(Sylgard 186)等双轴预拉伸(初始厚度:2.0μm,拉伸后:1.4μm)。(b)悬浮拉伸1.4μm厚的PDMS膜,固定在PMMA支架上。(c)在悬浮膜上放置一个面罩。(d)在空气-水界面形成的单层电极在带有掩膜的悬浮PDMS膜上的LS转移。(e)PDMS上的图案化单层电极。(f)将覆盖有图案化单层电极的PDMS膜转移到较小的PMMA支架上。(g)图案化单层电极位于PDMS的下侧,电极与铜带连接,PDMS的上侧不带电极。(h)采用LS电极技术制造DEA。
在制造的DEA的两个电极之间施加高达130V的电压。测量中心活性区的直径线性应变,作为施加电压的函数。还测量了线性应变作为频率的函数,以表征DEA的速度。










