合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(三)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(二)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(一)
> 界面流变仪可以测量液体表面张力吗?界面流变仪与界面张力仪区别解析
> 测量表面张力/界面张力的仪器有哪些?怎么选
> PG脱酰胺添加量对玉米醇溶蛋白气-水动态表面张力的影响
> 芬兰Kibron表面张力仪使用指南【专业版】
> 平面流动皂膜表面张力系数、厚度和流动速度实验装置及测量方法(二)
> 平面流动皂膜表面张力系数、厚度和流动速度实验装置及测量方法(一)
> 单层膜界面上亚微米颗粒表面张力阻力系数修正——颗粒在单层膜上的阻力系数
不同种类的抗菌肽瓜娃素与生物膜之间的相互作用的性能对比【下】
来源:上海谓载 浏览 1680 次 发布时间:2022-07-05
随后,我们进行了如上所述的相同测量,但使用了temporin L。将temporin L添加到SOPC LUV中后,Ie和Im均降低(图4,面板A和B),其减量在肽:脂质摩尔比下趋于稳定≈1:8.当胆固醇(Xchol)0.10)包括在SOPC LUV中时,Ie和Im的减少有所减少,再次在1/1的时间脂质化学计量比稳定下来≈1/8.当存在酸性磷脂POPG时,肽的作用非常不同。与temporin B相反,temporin L降低了含有酸性磷脂POPG的LUV的Im,在XPOPG)0.10时影响最大(图4,面板A)。有趣的是,在XPOPG)0.10时,明显存在明显的不连续性,对应于POPG:temporin L摩尔比为1:1,因此表明形成了化学计量络合物。Im的减少在时间蛋白L:脂质摩尔比下趋于稳定≈1:5在XPOPG)0.10,而在XPOPG)0.20和0.40(图4,面板A)时,连续衰减很明显。随着脂质体中POPG含量的增加,Im的减少逐渐减弱。在XPOPG)0.10时,当时间蛋白L:脂质摩尔比为e时,Ie的值低于SOPC LUV的值≈1:8.超过该化学计量比,Ie的最大减量在XPOPG)0.10时明显,并且在时间蛋白L:脂质摩尔比下减量达到平台≈1:5(图4,面板B)。与Im类似,随着XPOPG的增加,由时间蛋白L引起的Ie减少逐渐减弱。图5,面板A描述了Temporain L对Ie/Im的影响。添加Temporain L后,SOPC LUV的Ie/Im略有增加(图5,面板A),而在存在POPG时观察到显著增加。有趣的是,在XPOPG)0.10、0.20和0.40下,由于Temporain L导致的Ie/Im增量的微小差异很明显≈1:10.然而,当时间蛋白/脂质的化学计量比大于≈1/8,在XPOPG)0.20和0.40时Ie/Im的增量显著高于XPOPG)0.10时的增量。同样,在XPOPG)0.40时,Ie/Im进一步增加,高于1/1的时间蛋白/脂质化学计量比≈1/6(图5,面板A)。
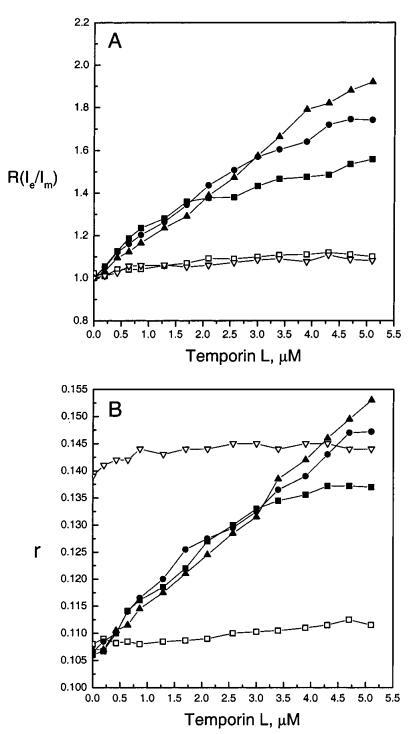
图5:通过芘标记的磷脂PPDPC(X)0.01)的荧光和DPH(X)0.002的稳态发射各向异性r评估颞叶素L对LUV中脂质动力学的影响,显示为含XPOPG)0(0)、0.10(9)、0.20(B)和0.40(2)的SOPC脂质体中归一化准分子与单体比率r(Ie/Im)(图A)和各向异性r(图B)的变化,Xchol)0.10(3)。每个数据点代表三次测量的平均值。标准偏差小于0.02(面板A)和0.004(面板B),为清楚起见,未显示。否则情况如图2图例所示。
为了与上文所述的temporin B相同的目的,我们还测量了由temporin L诱导的DPH各向异性r的变化。与temporin B类似,当将temporin L添加到SOPC和SOPC/胆固醇(Xchol)0.10)LUVs中时,r只有轻微变化(图5,面板B)。然而,在含酸性磷脂的膜中,时间蛋白L导致酰基链顺序强烈增加,明显表现为DPH各向异性显着增加(图5,面板B)。r的增量随着膜中XPOPG的增加而逐渐增加,高于时间蛋白L:脂质摩尔比≈1:6.由于Temporain L导致含SOPC和酸性磷脂的膜的Ie/Im显着增加,荧光脂质PPDPC在这些膜中富集。
时间蛋白对膜拓扑结构的影响。巨大脂质体是生物膜的优秀模型,因为其尺寸与细胞相当。此外,它们可以通过光学显微镜进行观察(15,21)。我们之前对马加宁2和吲哚肽的研究表明,这些肽对巨大脂质体膜的拓扑结构有显着影响(15)。在本研究中,在类似条件下,通过显微镜观察了在巨大囊泡外表面添加这些肽后,temporins对巨大脂质体三维拓扑结构的影响。SOPC巨脂质体即使暴露于大量该肽(约1.2 fmol的temporin B)(每个重复100份12 amol)时,也不受temporin B的影响。同样,含有胆固醇(Xchol)0.10)的巨大囊泡也不受该量的颞叶素B的影响。然而,在将该肽添加到SOPC和SOPC/胆固醇(Xchol)0.10)巨大脂质体的表面时,偶尔会观察到相邻囊泡之间的粘附(数据未显示)。然而,在POPG(XPOPG)0.10的存在下,已经≈36 amol(10-18 M)的颞叶素B(约60 fL,3次注射)施加在巨大囊泡表面上,引起巨大囊泡膜拓扑结构的显着变化(图6,面板B)。具体来说,小颗粒(φ≈10µm),然后进入巨大脂质体的内腔(图6,面板B)。进一步增加≈0.24 fmol的颞蛋白B(约400 fL,20次注射)导致巨大囊泡内这些颗粒的数量增加(图6,面板C)。还观察到巨大囊泡表面的颗粒聚集(图6,面板C)。随后,在≈10分钟后,将颗粒转移到巨大脂质体的内腔中。
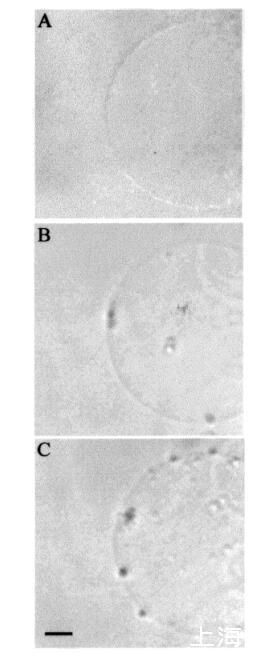
图6:temporin B诱导的巨大SOPC/POPG(XPOPG)0.1)脂质体转化的HMC图像。添加temporin B之前的巨大囊泡(图a),应用后5秒≈36 amol颞蛋白B(面板B),添加≈0.24 fmol的颞蛋白B(面板C)。面板C中比例尺的长度对应于50µm。
然后我们研究了颞叶素L对巨大脂质体的影响。图7所示的图像序列说明了由于temporin L引起的SOPC巨大脂质体的转化。有趣的是,大约12 amol temporin L(1次注射)已经影响了SOPC膜的外观,在添加肽后1秒内,巨大囊泡内出现聚集结构(图7,面板B)。此外,相邻的巨大囊泡也受到类似囊泡形成的影响(图7,面板B,研究的巨大脂质体下方)。进一步添加temporin L(最多≈0.12 fmol,共10次重复注射)不会诱导进一步的囊泡形成,而两个“内吞”聚集体粘附在肽微注射部位的巨大脂质体表面。大约5分钟后,这两个“内吞”聚集体粘附在一起,在巨大囊泡内形成一个更大的聚集体结构(图7,面板C)。与颞叶素L对SOPC巨脂质体的作用类似,该肽在POPG(XPOPG)0.10存在下诱导类内吞过程,图8)。更具体地说,在添加约12 amol的temporin L(1次注射)后,暴露于肽的巨大脂质体表面的区域变暗,显示折射率的显著变化,并指示形成紧密堆积的三维结构,仅部分保留在焦平面中(图8,面板B)。在内部≈1秒后,巨大脂质体内出现了小颗粒聚集体和暗区(图8,面板C)。同时,还观察到相邻巨大囊泡中的囊泡形成(图8,图B和图C)。随后总共增加了≈24阿米尔的颞叶素L(2次注射)使另一组“内吞”小颗粒出现在巨大脂质体内,与先前形成的聚集体粘附(图8,面板D)。之后≈1分钟,其中一些颗粒(φ≈8µm)从巨大脂质体内的双层释放(数据未显示)。有趣的是,在进一步添加约12 amol的Temporain L(总共3次注射)后,分离的小颗粒再次聚集,暗区的面积增加(图8,面板E)。暗区面积的增加通过添加另一个≈24 amol temporin L(共5次注射)。几分钟后,聚集的“内吞”小颗粒进入巨大囊泡的内腔,而膜表面的暗区消失(图8,面板F)。同时观察到相邻的巨大脂质体的囊泡形成。有趣的是,在胆固醇(Xchol)为0.10的情况下,需要更多的时间蛋白L来诱导囊泡形成(图9)。然而,在添加约0.24 fmol(20次注射)的Tempolin L后,小颗粒的“内吞”聚集物以及≈巨大脂质体内出现直径为9µm的颗粒(图9,面板B)。随后添加≈0.24 fmol的肽(共40次注射)在巨大囊泡内诱导另一组小颗粒,约30秒后与第一个聚集物合并(数据未显示)。然而,随后进一步添加temporin L(高达约1.2 fmol,100次注射)对巨大脂质体膜没有进一步的可见变化。

图7:添加temporin L之前,添加temporin L后1s,由temporin L.巨大囊泡引起的SOPC巨大脂质体转化的HMC图像(图a)≈12 amol的temporin L(面板B),并在应用总计≈0.12 fmol的temporin L(面板C)。面板C中比例尺的长度对应于50µm。
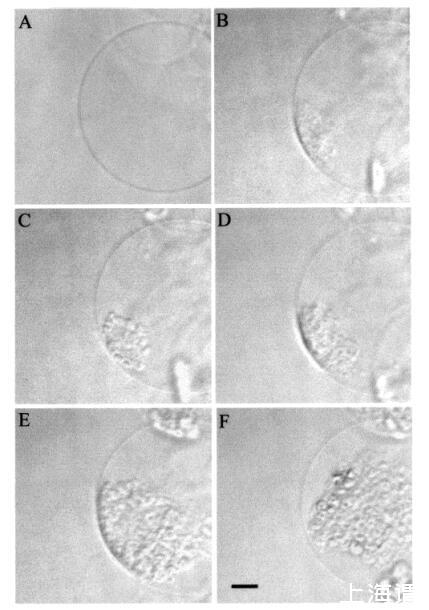
图8:HMC图像,描绘了应用temporin L之前以及添加temporin L后立即(面板B)、1秒(面板C)由temporin L.巨大囊泡诱导的巨大SOPC/POPG(XPOPG)0.1)脂质体的转化≈12 amol Temporain L,并在添加后立即(面板D)≈24 amol的颞叶素L。在注射了总计≈36 amol(E组)的temporin L,以及在添加总计≈60 amol temporin L。面板F中比例尺的长度对应于50µm。
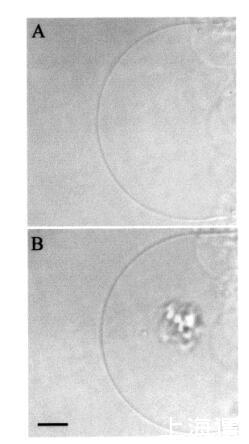
图9:HMC图像序列,说明了在添加肽之前(图a)和应用肽后立即通过temporin L.巨大囊泡转化SOPC/胆固醇(Xchol)0.10)巨大脂质体≈0.24 fmol的temporin L(面板B)。面板B中比例尺的长度对应于50µm。
讨论
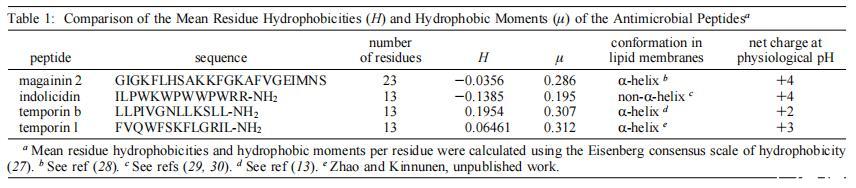
我们的长期目标是建立最低的序列要求,这可以进一步作为设计新型抗菌肽类似物的指导原则。我们之前已经比较了两种抗菌肽,马盖宁2和吲哚肽对本研究中使用的相同模型膜系统的影响,即。,单层、脂质体和巨大囊泡(15)。我们早期研究中使用的肽是选择的,因为它们代表两种不同类型的抗菌肽家族。在本研究中,我们使用了两种13个氨基酸的肽,即与吲哚肽长度相似的肽。肽的结构参数不同,如电荷、构象、疏水性、疏水力矩和大小(表1)。有趣的是,在所研究的四种肽中,以摩尔为基础计算的时间蛋白L最有效,作用于中性和酸性磷脂膜。与其他三种肽相比,其净阳离子电荷和疏水性具有平均值(表1)。然而,在所示的肽中,temporin L具有最高的平均疏水力矩,这表明这可能是与其有效的膜扰动作用相关的一个重要参数,这与之前比较magainin 2和其他抗菌肽的研究一致(31)。
虽然上述抗菌肽对模型生物膜的作用存在明显差异,但也存在一些明显的相似之处。所有四种肽与脂质的相互作用可以根据不同的过程进行表征,如下所示。肽首先结合并插入膜。这一过程通过与酸性磷脂形成复合物而得到增强,并涉及形成复合物。插入伴随着酰基链顺序的增加。由于阈值肽:脂质摩尔比,整体相互作用是协同的,意味着形成由肽酸性磷脂复合物组成的聚集结构。最后,还形成了更宏观的聚集体,这在显微镜图像中很明显。在下文中,我们将讨论上述过程以及提供各自驱动力的潜在机制。
与马加宁2和吲哚西啶(15)类似,颞叶素B和L都具有高度的膜活性(图1)。同样,在酸性磷脂存在的情况下,所有四种肽与单分子膜的相互作用增强,与其净正电荷保持一致(表1)。CD光谱表明,在疏水环境中,temporins采用R-螺旋结构(13,Zhao和Kinnunen,未发表的数据)。此外,它们的螺旋轮投影揭示了两亲性。temporin B引起的π增加的动力学与temporin L的动力学不同(图1,图A和B),表明在前一个肽最初插入脂质膜后,构象和/或方向发生了变化。换句话说,时间蛋白B与脂质单层的相互作用将包括以下步骤,即:(i)颞蛋白B与单层表面的结合,(ii)颞蛋白B嵌入脂质膜,其长轴可能平行于膜平面,以及(iii)肽的快速重新定向,垂直于单层表面。因此,后一个过程将导致观察到的π突然下降(图1,面板B)。然而,也可能在(iii)期间,与肽相关的一些POPG分子的方向不同于单分子膜大部分的磷脂,如吲哚肽(15)所示。
POPG的存在导致增强∆π由于时间蛋白B在π<32 mN/m时,后一个值因此代表了∆π-π0图,类似于吲哚肽(15)。因此,低于后一个表面压力,∆π随着XPOPG的增加而逐渐增加,而在π>32 mN/m时观察到相反的情况。一个类似的“交叉”点,尽管在更高的表面压力为≈43 mN/m对Temporain L也很明显(图1,面板D和E)。然而,对于该肽,随着XPOPG的增加,πc明显减少(图1,图E)。“交叉”点≈在我们之前的研究中观察到吲哚肽为38 mN/m。然而,有趣的是,magainin 2(15)没有这种特征。“交叉”点对这些肽作用机制的可能意义值得进一步研究。对于真核细胞质膜,平衡侧压力估计为≈32 mN/m(有关简要回顾,请参阅16、32)。据我们所知,原核生物膜的平衡侧压力未知。然而,似乎可以合理地假设,双层的基本物理化学性质可以决定两种类型细胞中的侧向压力大小相似。从定性上讲,更具表面活性的肽,颞叶素L和吲哚肽,具有较高的“交叉”压力值。
本文报道的颞叶素B和颞叶素L对双层脂质动力学的影响与之前报道的马盖宁2和吲哚肽的影响极为相似(15)。因此,DPH各向异性r的增加表明,在酸性磷脂POPG存在的情况下,所有这些肽都增加了酰基链顺序,这种作用的幅度随着XPOPG的增加而增加。同样,在酸性磷脂的存在下诱导脂质分离。所有这些效应都表明了酸性磷脂以及肽的阳离子电荷对于后者与生物膜相互作用的重要性。对于magainin 2和Tempolin B,在POPG存在下,SOPC和SOPC/胆固醇(Xchol)0.10)脂质体中的芘荧光猝灭被消除,而对于Tempolin L和吲哚青素,无论脂质成分如何,都观察到了这一过程。芘和色氨酸之间的π-π相互作用以及肽(15)的碱性残基与荧光团的接触导致π-阳离子相互作用(33)可能参与猝灭。此外,在肽的存在下,荧光团的微环境可能变得更亲水,从而降低荧光量子产率。与马盖宁2和吲哚肽(15)相反,在胆固醇(Xchol)0.10存在的情况下,由Temporanins B和L引起的芘淬灭减弱,因此表明胆固醇可能抵消后两种肽的膜插入。
在XPOPG)0.40时,颞叶素B在肽:脂质摩尔比为≈1:30而在该化学计量比之上,Ie/Im降低(图3,面板A)。由于在XPOPG)0.40处,颞蛋白B与膜的强烈相互作用,不同的作用可能有助于减少芘脂质类似物的准分子形成,如下所示。首先,膜结合的颞蛋白B可以代表荧光探针横向扩散的机械屏障。换句话说,膜相关肽可以通过占据探针的相邻位置静态减少准分子的形成,从而增加芘标记脂质在碰撞之间扩散的路径长度。其次,由于肽-脂质相互作用,邻近肽的脂酰基链的旋转自由度可能会降低。第三,与肽相邻的脂质可以部分固定,因此它们的交换频率(以及该区域中芘分子的交换频率)显着低于大块脂质基质中的交换频率。相反,对于temporin L,Ie/Im的值随着XPOPG的增加而逐渐增加。同样,当肽:脂质摩尔比>1:6时,DPH各向异性r的增加取决于XPOPG(图5)。该化学计量学可表示阈值浓度,高于该浓度时,酸性磷脂膜中发生协同肽插入和重排。temporin L的单个Trp残基可以促进其分配到脂质双层(34),并且在酸性磷脂存在的情况下,temporin L可能插入膜更深,或者膜中的肽量可能随着XPOPG的增加而增加。与含有五个色氨酸残基的吲哚西啶相比,temporin L只有一个色氨酸残基,净正电荷少一个(表1)。然而,颞叶素L在含SOPC和POPG的膜中更有效地淬灭芘标记的脂质。颞叶素L比吲哚肽疏水性更强,具有更大的疏水力矩(表1)。这些性质可以促进颞叶素L插入脂质双层。
我们对芘标记脂质的研究表明,temporin B和temporin L在SOPC以及SOPC/POPG膜中引起脂质侧向分离,从而形成富含肽的微区。对于酸性磷脂膜,这些结构域可能与双层中孔的形成有关。带负电的脂质的存在有助于减少带正电的肽之间的排斥静电,从而允许它们在膜中聚集。更具体地说,正如马加宁2和吲哚肽(15)所建议的那样,肽首先会积聚在双层的外小叶中。在达到阈值表面浓度后,双分子层中的肽将以合作的方式重新定向。因此,当阳离子肽和酸性磷脂在双层表面上共分离成微区时,可实现高局部肽浓度。然后,这种不对称性将通过形成由肽和脂质的超分子聚集体构成的“通道”或“孔”来缓解,从而允许肽扩散到双层的内小叶中。同时,双层结构将局部失稳。孔形成作为这一过程的中间步骤是可以想象的,因为时间蛋白已被证明可诱导脂质体包埋荧光探针的释放(13)。较长的线性肽,如马盖宁2和mellitin在人工膜中形成孔(28、35),跨膜肽通道的最小长度约为23个残基。就时间蛋白而言,区分目前提出的孔隙模型将特别有趣。它们可以以更复杂的方式形成孔,可能涉及肽的二聚化(9)。与马盖宁2和颞叶素B相反,颞叶素L和吲哚西啶会引起SOPC和SOPC/胆固醇(Xchol)0.10)巨大囊泡的水泡化,这可能与其溶血活性有关(36,Simmaco,M.,未发表的观察结果)。在这方面,比较上述抗菌肽与从欧洲蜜蜂中分离出的高度溶血性肽mellitin的效果很有意义。抗菌肽magainin 2和temporin B对含有负电荷磷脂的膜有显著影响,而对中性膜的影响较小。虽然溶血肽temporin L和indolicidin优先与酸性磷脂结合,但它们也与两性离子膜表现出强烈的相互作用。颞叶素L尤其如此,它诱导中性巨囊泡的显著囊泡化。有趣的是,mellitin在两性离子膜中诱导各种形态不同的相,这取决于肽脂比和脂质的相态,包括多层膜的囊泡化、小脂质囊泡的融合,以及碎裂成圆盘和胶束(37)。然而,在带负电的磷脂POPG存在下,其渗透两性离子磷脂囊泡的能力显著降低。提出了中性多层膜中的跨双层取向,但在带负电的多层膜中没有(38)。因此,这些数据表明两性离子膜和这些肽之间存在明显的疏水相互作用,使后者溶血,而静电相互作用似乎是其抗菌活性所必需的。为此,哺乳动物质膜的外小叶仅由两性磷脂组成,而细菌膜包含大量酸性磷脂、磷脂酰甘油和心磷脂(39)。
有趣的是,我们实验室迄今为止研究的所有肽在巨大囊泡中也诱导类似内吞的过程,然而在聚集结构中观察到的差异表明四种肽与膜的结合模式不同。显微镜图像显示宏观聚集体的形成是不对称的,即发生在巨大的囊泡内。与我们关于鞘磷脂酶形成神经酰胺的研究类似(21),抗菌肽作用的矢量性质表明,其不对称应用于外表面会增加膜的弯曲刚度和负的自发曲率。然而,机制的阐明需要进一步研究。显微镜下可见的聚集体的性质令人感兴趣。为此,提出了层状液晶相不代表热力学平衡的可能性。因此,已证明二甲基磷酸甘油转化为所谓的“海绵”相(40)。控制这一阶段形成的因素仍知之甚少;然而,脂质-头群相互作用似乎很重要。一个有趣的可能性是,除了对双层膜的其他作用外,这些抗菌肽还可以触发细菌脂质磷脂酰甘油从层状液晶状态过渡到“海绵”相,后者代表热力学平衡。在热力学水平上,这也将为在巨大脂质体中观察到的肽-脂质复合物的宏观聚集提供驱动力。然而,在这种情况下,机械基础也需要进一步研究。










