合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(四)
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(三)
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(二)
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(一)
> 新型多羟基苯磺酸盐驱油剂的界面张力优化及油田应用潜力分析(三)
> 新型多羟基苯磺酸盐驱油剂的界面张力优化及油田应用潜力分析(二)
> 新型多羟基苯磺酸盐驱油剂的界面张力优化及油田应用潜力分析(一)
> 基于最大气泡压力方法测量液态锂锡合金表面张力
> 烷基糖苷表面活性剂界面张力与润湿性相关性研究(二)
> 烷基糖苷表面活性剂界面张力与润湿性相关性研究(一)
通过调节薄脂蛋白膜的亲水性非表面活性聚合物的表面性质
来源:上海谓载 浏览 1664 次 发布时间:2022-08-18
摘要
我们研究了亲水聚合物(HPs)逆转白蛋白抑制作用和恢复脂质蛋白肺表面活性剂制剂(LSP)表面活性的能力:Curosurf和Survanta。暗示的HPs是葡聚糖和聚乙二醇10000(PEG1000)。在空气/水界面的薄膜(单层和泡沫)中评估LSP的表面活性。白蛋白从界面上取代LSP,并抑制其在单层中维持低表面张力和形成稳定的泡沫薄膜(FF)的能力。当HPs添加到单层中时,它们恢复LSP的表面活性并恢复其维持低动态表面张力的能力。类似地,泡沫膜中HPs的加入导致白蛋白效应的中和,并形成具有均匀表面的稳定薄膜(厚度<17 nm),如纯LSP的情况。我们的发现允许我们寻找一个有趣问题的答案,为什么PEG更好地恢复了Survanta的表面活性,而葡聚糖-则恢复了Curosurf的表面活性。这些结果可能对成人呼吸窘迫综合征的治疗具有重要意义。
介绍
肺表面活性物质(LS)是一种复杂的脂质-蛋白质混合物,在肺泡表面形成各种薄膜。它的主要功能之一是在呼气时压缩肺表面时达到较低的表面张力,并防止肺泡塌陷。
许多外源表面活性剂制剂(ESP)能够在纯空气/水界面快速吸附并降低其表面张力。由于其高表面活性,这些制剂在治疗特发性呼吸窘迫综合征(一种新生儿患有表面活性剂不足且肺泡空气/水界面“纯净”且“开放”以补充表面活性剂的疾病状态)方面是有效的。然而,最近另一种病理学正在增加其发病率:所谓的成人呼吸窘迫综合征(ARDS)。在ARDS患者中,肺泡内发生血液渗漏,空气/水界面被吸附的血浆蛋白,尤其是最丰富的血液蛋白血清白蛋白“阻断”。目前可用的ESP对于ARDS治疗是无效的,因为它们不能从表面置换白蛋白分子,并且不能吸附和降低表面张力。因此,迫切需要找到一种调整ESP界面性质的方法,以恢复药物制剂在白蛋白存在下的表面活性。
在目前的工作中,我们研究了两种ESP(Survanta和Curosurf)在被吸附的牛血清白蛋白(BSA)阻挡的空气/水界面的薄膜中的表面行为。所采用的薄膜是单层和泡沫膜。单层张力测定法用于测量表面活性剂制剂压缩单层表面积后获得的最小表面张力γmin。泡沫膜(FFs)由两个相互粘附的头对头脂质蛋白单层组成。虽然FFs被认为是(1)体外评估肺表面活性物质制剂界面性质的有力工具,但这是FFs首次用于研究白蛋白对ESP表面行为的影响。
ESP使用纯的且在非表面活性亲水聚合物(HPs)葡聚糖和聚乙二醇10000(PEG1000)存在下。选择这些HPs是因为它们被认为通过正耗尽吸引渗透压的机制防止白蛋白诱导的表面活性剂抑制(2)。
材料和方法ESP(Survanta和Curosurf)从生产商处获得。NaCl、牛血清白蛋白(BSA)、PEG 10000和右旋糖酐(Mw 79 400)购自“西格玛”。所有溶液均采用超纯去离子水(电导率小于0.1μS)制备。
单分子膜在朗缪尔槽(表面积118 cm2)中形成单分子层,并使用微槽X张力计(Kibron Inc.,芬兰)使用铂丝探针通过Wilhelmy方法测量表面张力。使用两种亚相:(i)表面张力为72.9mN/m的纯盐水溶液——用于纯空气/水界面的对照实验;(ii)表面张力约为50mN/m、溶解白蛋白(2mg白蛋白/ml)的盐水溶液。当暗示葡聚糖或PEG 10000时,它们在亚相中溶解至5%的最终浓度。在该量下,HPs不会改变溶液的表面张力。通过Hamilton microsyringe将ESP制剂(在没有和存在HPs的情况下)作为脂质体悬浮液分散在空气/水界面上。大约用了一个小时来准备在界面上传播。然后进行十次连续的面积压缩/减压循环,其中单层被压缩在118cm2(初始表面积)和23.6cm2(初始表面面积的20%)之间。压缩速度为140mm/min。记录了在最小单层表面积下获得的最小表面张力γmin(mN/m)。
泡沫膜如前所述(3),在Scheludko和Exerowa的测量池中形成微观泡沫膜。通过倒置光学显微镜观察它们,并通过干涉测量技术测量膜厚度h(nm)。FFs的照片由Olimpus C-7070宽变焦相机拍摄。
结果和讨论
单层
当在纯空气/水界面扩散时,ESP、Curosurf和Survanta在十个区域压缩/减压循环中达到并保持低于10 mN/m的最小表面张力(图1)。
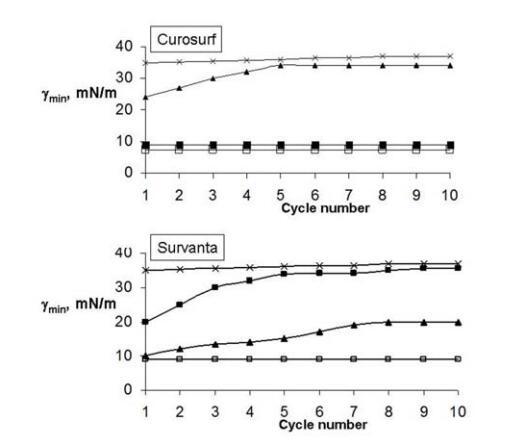
图1.Curosurf(上图)和Survanta(下图)单层的最小表面张力(γmin)对压缩/减压循环次数的依赖性。符号表示:□-纯空气/水界面处的ESP(盐水溶液亚相上);在BSA亚相上的x-ESPs(2mg/ml);■-在BSA(2mg/ml)和5%葡聚糖的亚相上进行ESPs;▲-在BSA亚相(2mg/ml)和5%PEG 10000上进行ESP。ESP作为脂质体悬浮液扩散,最终浓度为15μg磷脂/ml。实验在0.15 M NaCl、pH 6.8-7.0、T=25℃下进行。
白蛋白的存在损害了制剂的表面性质,两者的γmin约为30mN/m。单层亚相中HPs的存在允许恢复ESP维持低γmin值的能力。葡聚糖在恢复Curosurf的表面活性方面比PEG 10000更有效(图1上图)。可以看出,在PEG存在下,Curosurf在第一次压缩/减压循环期间达到20mN/m的最小表面张力,该最小表面张力随着循环次数不断增加,直到达到大于30mN/m。相反,当葡聚糖包含在亚相中时,Curosurf表现出与纯空气/水界面相同的行为,并在所有连续循环中保持γmin=9 mN/m。
与上述结果相反,在Survanta的情况下,PEG 10000比葡聚糖更有效(图1下图)。在葡聚糖存在下,Survanta获得了20mN/m的γmin(第一次循环),在随后的循环中增加到30mN/m以上。PEG的加入允许Survanta在第一次循环中达到9 mN/m的最小表面张力(与纯空气/水界面处的值相同),尽管在随后的循环中(第8次至第10次循环)它上升到20 mN/m的平台值。有必要将Survanta的体积浓度增加到200μg PL/ml,以便在所有压缩/减压循环期间保持约10mN/m的γmin(数据未显示)。
纯空气/水界面处的泡沫膜Curosurf形成厚度为15 nm的稳定普通黑色膜,而Survanta形成由薄黑色区域(h=17 nm)组成的异质FFs,其中较厚区域被困在膜内(图2)。向ESPs中添加HPs不会改变在纯空气/水界面处形成的黑色膜的类型和厚度。

图2 ESPs形成的普通黑色薄膜。实验在250μg磷脂/ml 0.15 M NaCl、pH 6.8-7.0、T=25℃下进行。
当白蛋白存在于膜芯中时,ESP形成黑色膜的能力受到抑制,并形成厚(h>100nm)异质膜(图3A和4A),类似于由纯白蛋白溶液形成的FFs。
通过Curosurf和白蛋白将PEG 10000包含到混合FFs中不会改变膜类型,并且FFs仍然厚且不均匀。相反,葡聚糖的加入导致了显着的变化:观察到薄膜变薄且稳定的黑色薄膜(h=15 nm),类似于在没有白蛋白的情况下通过Curosurf获得的薄膜(图3)。
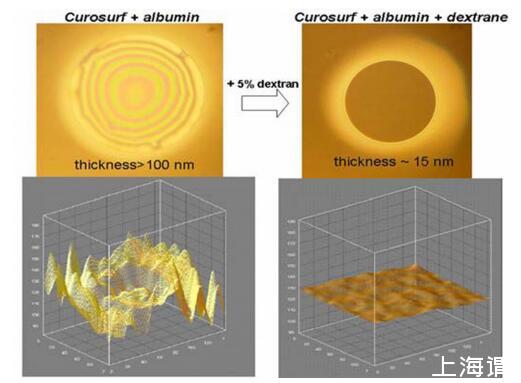
图3.在250μg磷脂/ml、0.15 M NaCl、pH 6.8-7.0、T=25℃条件下,通过Curosurf和BSA进行混合FFs以及添加葡聚糖对膜形态的影响实验。
当通过Survanta和白蛋白添加到混合FFs中时,葡聚糖不会改变膜的性质。然而,当FFs中包含PEG 10000时,富含白蛋白的厚膜分解成更小的厚“岛”,岛之间有薄的(h=17 nm)黑色区域(图4)
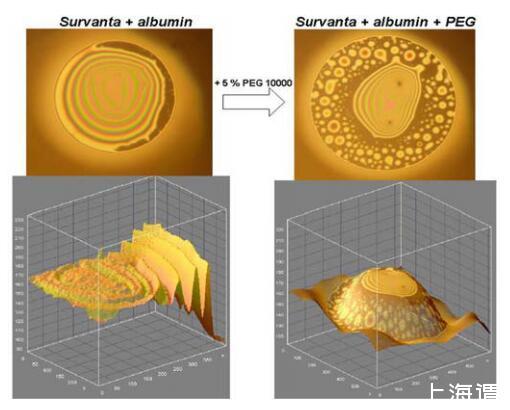
图4.通过Survanta和BSA的混合FFs以及PEG 10000添加对膜形态的影响。黑色区域的厚度为17nm。实验在250μg磷脂/ml、0.15 M NaCl、pH 6.8-7.0、T=25℃下进行。
讨论和结论
白蛋白抑制外源表面活性剂制剂在空气/水界面的表面活性。当BSA出现在膜液相中时,Curosurf和Survanta都失去了在单层中保持低最小表面张力和形成黑色泡沫膜的能力。
通过ESP和白蛋白将亲水聚合物包含在混合薄膜中,恢复了药物制剂的表面活性,ESP从空气/水界面置换了白蛋白。后者导致(i)单分子膜中ESP低γmin值的恢复,以及(ii)ESP形成黑色泡沫膜的能力的恢复。
值得注意的结果是,两种亲水性聚合物葡聚糖和PEG 10000在BSA存在下恢复ESPs表面性能的效率不同:葡聚糖对Curosurf更有效,PEG 10000-对Survanta更有效。这表明HP的影响不仅可以用正渗透压来解释,还可能与聚合物对本体表面活性剂聚集体结构的不同影响有关(4)。
当前工作的重要影响是首次实施自由流,以研究白蛋白和亲水聚合物对ESP表面行为的影响。
致谢
我们感谢保加利亚教育和科学部拨款DVU01/0406提供的财政支持。










