合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 基于界面张力和表面张力测试评估商用UV油墨对不同承印纸张的表面浸润性差异(三)
> 基于界面张力和表面张力测试评估商用UV油墨对不同承印纸张的表面浸润性差异(二)
> 基于界面张力和表面张力测试评估商用UV油墨对不同承印纸张的表面浸润性差异(一)
> 分子动力学模拟不同浓度仿生黏液-水界面的界面张力
> 温度对水—十二烷基硫酸钠体系与纯水体系界面张力、厚度的影响——结果与讨论、结论
> 温度对水—十二烷基硫酸钠体系与纯水体系界面张力、厚度的影响——模拟方法
> 表面张力:微观力场中的宏观奇迹
> 表面活性剂如何有效降低油水界面张力
> 什么是界面张力,界面张力影响因素
> 水的表面张力现象及其应用
人胰岛素的朗缪尔单分子层膜的表面化学和光谱学性质——结果和讨论
来源:上海谓载 浏览 1964 次 发布时间:2021-11-29
3. 结果和讨论
3.1. 表面压力和表面电位面积等温线。 表面压力和表面电位 − HI-Langmuir单层的面积等温线如图1所示。 表面压力和表面电势的提升对应于750和900Å2分子 − 分别为1。 与表面压力相比,人们期望在更大的表面电势区域观察到升力。 这是由于表面偶极子的长程相互作用,而范德华相互作用主要由表面压力测量。 关于极限分子面积,即表面压力线性部分的外推 − 零表面压力的面积等温线,值为620Å2分子 − 获得1。 该区域对应于空气中HI蛋白的最紧密状态 − 水界面,该值与先前发表的关于牛胰岛素Langmuir单层的研究一致。3,17
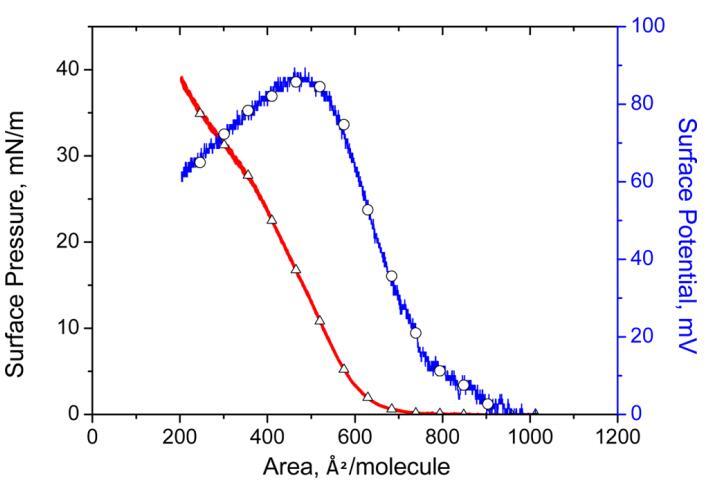
图1。 表面压力( △) 表面电位 − 区域( ○) 亚相pH值5.6时人胰岛素Langmuir单层的等温线。
将分子面积从750减小,可以观察到表面压力下的气-液膨胀相变 − 面积等温线。从585进一步降低到350表明朗缪尔单层的液体冷凝相。一个达到坍塌表面压力25.2mN m − 1.坍塌前的表面压力测量显示π线性增加 − 等温线。稳定性测量的下一节将显示HI-Langmuir单层在二维中是稳定的。
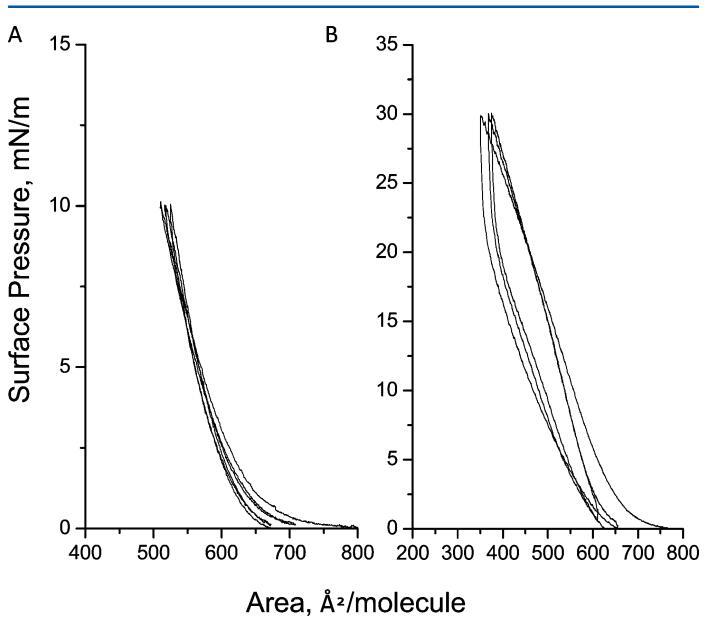
图2.三个压缩 − 在亚相pH值5.6下,减压循环达到10(a)和30 mN/m(B)的人胰岛素Langmuir单层表面压力。
3.2.压缩 − 人胰岛素Langmuir单层的减压周期和稳定性等温线。图2A和B显示了压缩 − 在两个目标表面压力(即10和30 mN m)下测得的减压循环等温线 − 1.选择这两种表面压力的基本原理是观察液体冷凝膜中膜在坍塌表面压力前后的稳定性。压缩后 − 从0到10和30 mN m的减压循环 − 1,我们观察到初始压缩和最后减压(第三个循环)之间的变化分别小于5%和10%。这一结果表明HI蛋白仍保留在界面上。必须指出的是,高达10 mN m的循环 − 1显示了等温线的重叠,这支持了胰岛素蛋白可能在液体膨胀和浓缩阶段保持其构象的解释。关于HI-Langmuir单层的稳定性(图3),观察到当单层在10和30 mN m保持恒定时,面积随时间减少 − 1在6500年代期间。测量到10和30 mN m的下降15%和60% − 1。崩塌后,崩塌表面压力预计会大幅降低。通过BAM研究HI聚集的可能性,并将HI与FITC结合,稍后将讨论。
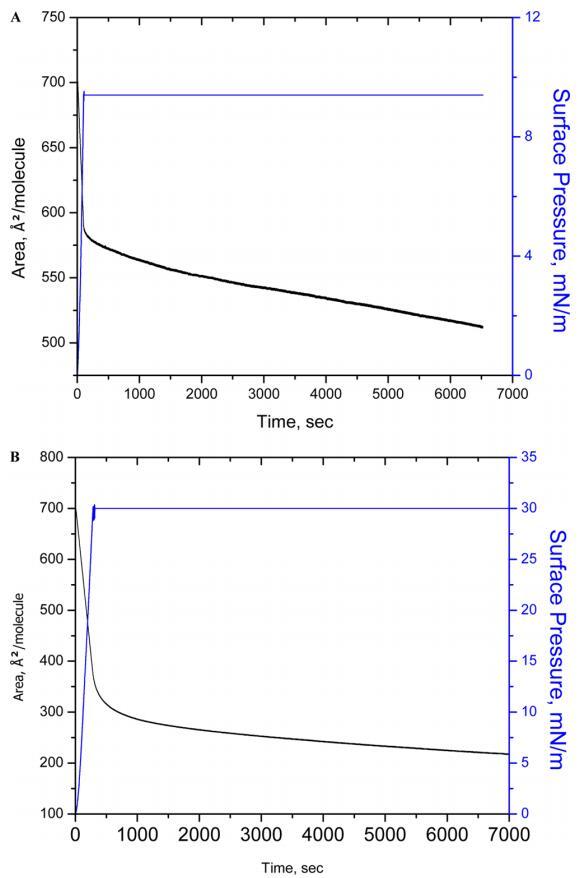
图3.在亚相pH值5.6下,在表面压力为10(A)和30 mN/m(B)的条件下,对人胰岛素Langmuir单层膜进行90 min的稳定性测量。
3.3.紫外线 − 人胰岛素在水相和Langmuir单层膜中的可见光谱和荧光光谱研究了HI在水溶液(pH 2)中的光物理性质 和作为Langmuir单层,分别如图4和图5所示。图4包括溶液中人胰岛素的吸收光谱和发射光谱。水HI(pH 2)的发射峰 当在270 nm处激发时,在305 nm处观察到。该峰对应于HI中存在的四种酪氨酸氨基酸。该值与在pH值为7(即303)的其他工作中获得的值相当 − 然而,在空气中为305 nm.21 − 水界面,在270 nm激发时未观察到荧光(图5B)。观察到的唯一峰是294 nm处的拉曼峰。这可以解释为HI浓度低(0.3 mg/mL) 这是生成表面压力等温线所必需的。因此,由于HI作为Langmuir单层没有荧光,因此无法在作为Langmuir单层的HI和溶液中的荧光光谱之间进行关联或比较。
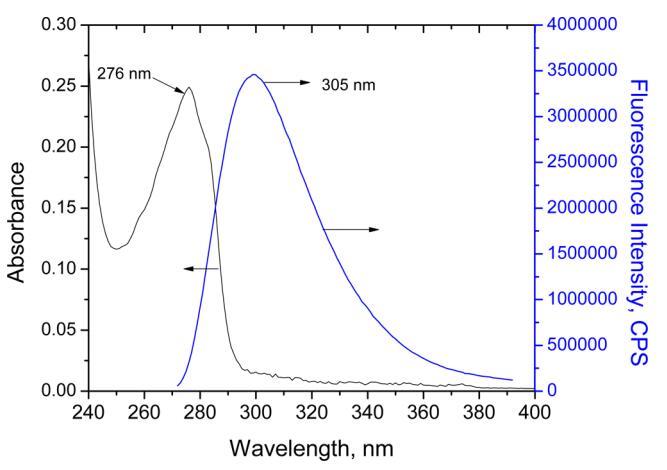
图4.紫外线 − vis(5×10 − 5米)和荧光(5×10 − 7 M;λ激发=270 nm,激发和发射处的狭缝宽度,分别为5和5 nm)人胰岛素水溶液的光谱。
通常蛋白质中的芳香族氨基酸在260左右出现峰值 − 280 nm,220附近有一个峰,这是由于肽键引起的。 图5A所示的光谱在紫外光谱中呈现出276 nm处的峰值 − 由于蛋白质中存在酪氨酸而产生的可见光谱。 除了276nm处的峰外,由于肽键的作用,蛋白质预计在190nm处有一个强峰,在210和220nm之间有一个弱峰。 在溶液中,观察到的人胰岛素的唯一峰值为276nm。 溶液中不同浓度的人胰岛素产生的光谱宽肩接近200 − 220 nm,表明肽键引起的峰重叠。 图5A显示了人胰岛素Langmuir单层的吸光度光谱。 在空中 − 在水界面,在224和276nm处观察到两个不同的峰,代表人胰岛素中存在的肽键和酪氨酸。 当这两个峰值与增加的表面压力对应时,它们呈线性关系。 空气中吸光度的线性 − 水界面表明HI单层在崩塌点之前的稳定性。
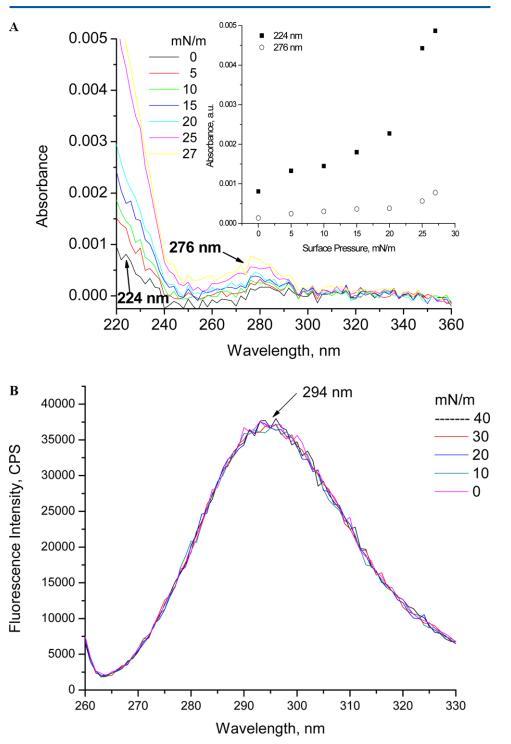
图5.(A) 紫外线 − 亚相pH值为5.6时人胰岛素Langmuir的可见光谱。 插图显示了224和276 nm处吸光度随表面压力的变化。 (B) 亚相pH 5.6下人胰岛素朗缪尔的荧光光谱(λ激发=270 nm,激发和发射时的狭缝宽度分别为5和5 nm)。
下一节将研究HI-Langmuir单层在二维域中潜在形成的地形。该观察使用了两种方法,即荧光法和布鲁斯特角显微镜。22,23
3.4. 人胰岛素朗缪尔单层的表观荧光和布鲁斯特角显微镜观察。 人胰岛素Langmuir单层的形貌通过FITC人胰岛素的表观荧光进行检查,而布鲁斯特角显微镜用于2-D纯人胰岛素。由于胰岛素是非荧光的,因此必须附加荧光团才能使用表观荧光显微镜。 蛋白质常用的探针是异硫氰酸荧光素(FITC)。
已知FITC胰岛素的比例(1:1),计算分子量,以制备在空气中摊铺的适当浓度的水溶液 − 水界面。 在5、10、20和30 mN m的表面压力下获得了表面荧光显微照片 − 1,如表1所示。 在所有表面压力下均观察到均匀的HI-Langmuir单层,图像中未显示μm范围内的畴的形成。 为了验证这一观察结果,采用布鲁斯特角显微镜(BAM)在与表观荧光显微镜相同的压力下对薄膜的形貌进行成像。 BAM数据证实了表观荧光测量结果。 为了确保BAM系统正常工作,对花生酸Langmuir单层进行了检查。 观察到的地形证实了已经公布的结果(表1)
表1。 通过(A)HI-FITC-Langmuir单层样品的表观荧光测量了四种表面压力; (B) BAM用于胰岛素HI-Langmuir单层; (C) 花生酸Langmuir单层BAM(胰岛素浓度:0.30 mg/mL)

3.5. 胰岛素的二级结构。 为了研究胰岛素分子在2-D中相互作用的性质,通过红外光谱检查HI水相和Langmuir单层。 研究了HI水相的FTIR和圆二色谱(CD),而HI-Langmuir单层膜采用红外反射吸收光谱(IRRAS)。
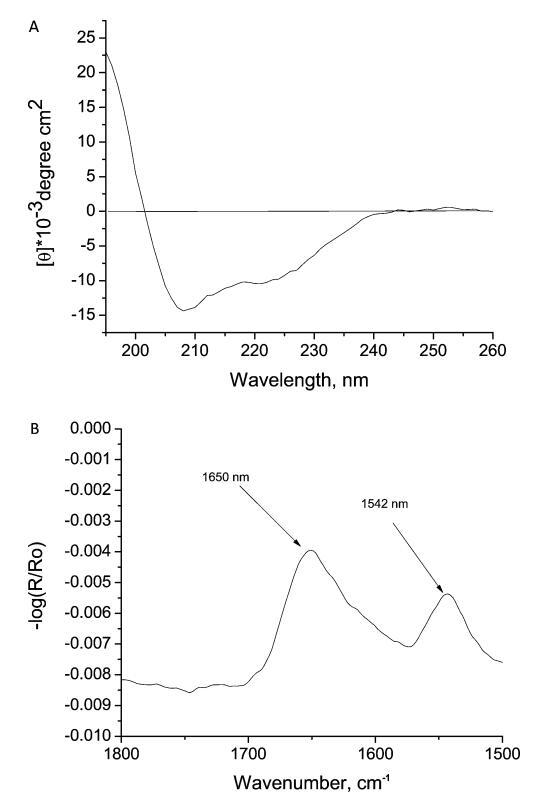
图6。 (A) 在pH 2和温度20±1°C条件下,水性胰岛素的圆二色光谱和(B)FTIR光谱。胰岛素浓度分别为0.3和2 mg-mL − 分别为1。
如图6A所示,与β-片相比,CD光谱包含高比例的α-螺旋。 它表明水相中存在单体且不存在聚集体。24图6B显示了水相HI的FTIR光谱,主峰位于1650、1542、1440和1373 cm处 − 1. 1650和1542厘米处的峰值 − 1对应于α-螺旋的酰胺I和酰胺II区域。25 − 27 CD和FTIR光谱证实水性HI以α-螺旋存在,因此在水相中以单体形式存在。
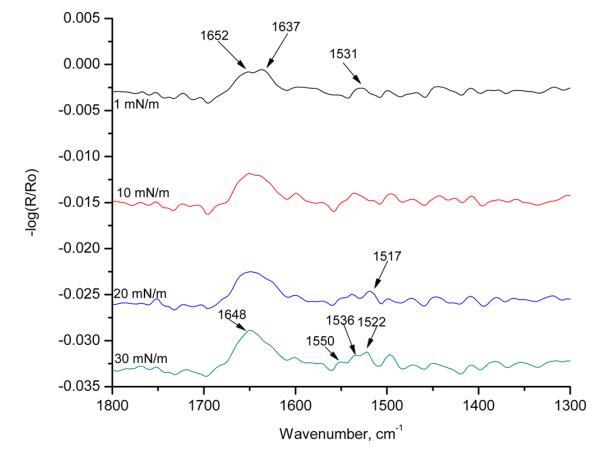
图7。 在亚相pH 5.6条件下,使用60°入射角和改变表面压力,对人胰岛素Langmuir单层膜进行p极化辐照。
IRRAS是研究Langmuir单分子膜在空气中取向和构象变化的重要技术 − 水界面。 IRRAS测量值作为反射率获得 − 吸光度(RA)与波数。 RA定义为 − log10(R/RF),其中R是薄膜覆盖表面的反射率,RF是水的反射率。28 − 30当振动与空气平行时 − 水界面,对于平行于入射面的p极化辐射,谱带最初为负值,其强度随着入射角的增加而增加,直到布鲁斯特角(2920 cm为54.5°) − 30通过在不同表面压力下使用IRRAS,我们研究了HI-Langmuir单层膜的取向和构象的变化(图7、8和9)。 IRRAS用于分析蛋白质的结构特征,例如通过1700区域的酰胺I和酰胺II带解释的α-螺旋和β-折叠 − 1600和1600 − 1500厘米 − 分别为1.19,20
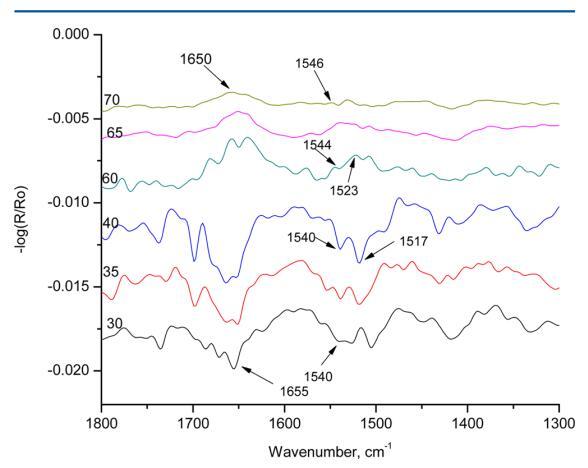
图8。 在亚相pH值5.6和表面压力10 mN/m以及改变入射角的条件下,人胰岛素Langmuir单层膜的p极化辐照。
给出了三种IRRAS光谱。 图7显示了不同表面压力下60°的极化,图8显示了10 mN/m的恒定表面压力和30到70°范围内的变化角度,图9显示了25°恒定角度和变化表面压力下的s极化。 表2给出了α-螺旋和β-片的谱带特征以及对应于α-螺旋的酰胺I和酰胺II振动。
图7显示了HI-Langmuir单层在不同表面压力下60°时的p极化。 这条带子在1517厘米处 − 1对应于α-螺旋。 在1 mN/m的表面压力下,有两个可见带:1652和1637 cm − 1. 随着表面压力的增加,这两个谱带重叠并成为一个宽带。 在30百万米 − 1,波段可视为单个波段,频率为1648厘米 − 1. 这是对应于α-螺旋的酰胺II区域的条带。 下一个波段在1531厘米处以1 mN/m的宽带出现 − 1. 随着表面压力的增加,它分成三个带:1550、1536和1522厘米 − 1. 在1550和1522厘米处的频带 − 1分别对应于α-螺旋和β-折叠中的酰胺II区域。 这种谱带分裂表明,谱带位于1531厘米处 − 在较低的表面压力下,1由α-螺旋和β-片组成。 在较高的表面压力下,谱带分离为离散的单个峰。 光谱中出现的其他峰是由于氨基酸和烷烃链的存在。 这条带子长1448厘米 − 1对应于C − H CH2和CH3的剪切。 HI-Langmuir单分子膜的p-极化辐照度中存在所有三个表明α-螺旋的主谱带。
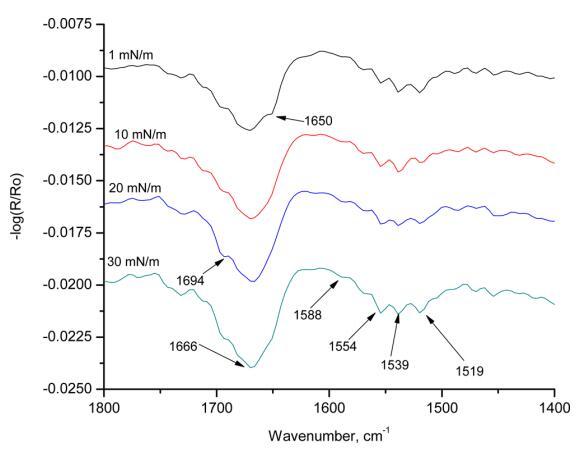
图9。 亚相pH为5.6,入射角为25°,且改变表面压力时,人胰岛素Langmuir单层的s极化辐照。
图8显示了HI-Langmuir单层在10 mN m处的p极化 − 1在30、35、40、60、65和70°的六个不同角度。 在布儒斯特角之前,30、35和40 mN/m处的角未显示出β片的特征带。 所有三个角度显示1655和1540厘米处的条纹 − 1分别对应于酰胺I和酰胺II吸收。 这条带子在1517厘米处 − 1,对应于α-螺旋,在35°和40°中存在。 在布儒斯特角之后,所有60、65和70°的三个角都显示出介于1650和1655之间的带,这对应于α-螺旋中的酰胺I吸收。 当角度为60°时,在1523 cm处可以看到峰值 − 1,对应于β片。 光谱中的其他谱带都不是α-螺旋或β-片的特征。 光谱表明HI在空气中以α-螺旋的形式存在 − 水界面。 在10 mN m的恒定压力下,随着角度的增加 − 1,发现光谱中的α-螺旋特征减少。
图9显示了在不同表面压力下获得的HI-Langmuir单层膜的s偏振辐照度。 在1 mN m的表面压力下 − 1,在1650 cm处存在一条带 − 1对应于α-螺旋。 随着表面压力的增加,该条带消失,并在1666 cm处并入该条带 − 1. 这条带子长1666厘米 − 1包括β-转角和α-螺旋。 这条带子有1694厘米长 − 1对应于β片。 这条带子在1519厘米处 − 1也对应于α-螺旋。 在入射角为60°的情况下,在1670处观察到的能带可归属于存在于β-转角中的空间约束C=O部分,或者由于β-薄片中的跃迁偶极耦合而注意到峰值中的分裂。 当改变表面压力时,最强烈的谱带出现在1554和1539厘米处 − 1,两条带均对应于酰胺II区的α-螺旋。 所有三条主谱带都表明HI-Langmuir单层的s极化辐照度中存在α-螺旋。
表2。 α螺旋和β片的主带位置特征及酰胺Ⅰ和酰胺Ⅱ的红外振动

从上述CD、FTIR和IRRAS数据可以得出结论,溶解在pH 2中的HI在溶液和空气中以螺旋构象存在 −
人胰岛素的朗缪尔单分子层膜的表面化学和光谱学性质——摘要、介绍
人胰岛素的朗缪尔单分子层膜的表面化学和光谱学性质——实验部分
人胰岛素的朗缪尔单分子层膜的表面化学和光谱学性质——结果和讨论
人胰岛素的朗缪尔单分子层膜的表面化学和光谱学性质——结论、致谢!










