合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
-
> Na2CO3溶液与模拟油反应不同时间后产物的界面张力、剪切黏度(二)
> 水包油型(O/W)和油包水型(W/O)乳液结构与界面稳定性
> 基于粒径、速度、表面张力、黏度测定揭示尘粒−雾滴碰撞行为规律(三)
> 玻璃刀切割玻璃的时候为什么要沾煤油?
> 新设计的拼接式固相萃取柱完美解决萃取柱出现空气栓塞问题
> 单萜萜类驱油剂界面张力、配伍性、降黏效果及破乳效果测试与筛选(一)
> 生物表面活性剂产生菌的筛选及对PAHs污染环境的修复效果研究(一)
> 土层中毛细水表面张力怎么计算
> 表面张力对乙醇液滴冲击过冷水平壁面的铺展动力学行为的影响(二)
> 基于石墨烯LB薄膜包裹的电化学阳极大规模制备方法
推荐新闻Info
-
> 烷基糖苷表面活性剂界面张力与润湿性相关性研究(二)
> 烷基糖苷表面活性剂界面张力与润湿性相关性研究(一)
> 嵌段比例对温敏聚合物表面张力的影响及临界胶束浓度分析(五)
> 嵌段比例对温敏聚合物表面张力的影响及临界胶束浓度分析(四)
> 利用表面张力优化浮选工艺:调整剂AY在石英-胶磷矿分离中的活性调控(二)
> 利用表面张力优化浮选工艺:调整剂AY在石英-胶磷矿分离中的活性调控(一)
> 嵌段比例对温敏聚合物表面张力的影响及临界胶束浓度分析(三)
> 嵌段比例对温敏聚合物表面张力的影响及临界胶束浓度分析(二)
> 嵌段比例对温敏聚合物表面张力的影响及临界胶束浓度分析(一)
> 温度和碳碳双键数对脂肪酸酯表面张力的影响(二)
为什么水与油互不相溶?
来源:老粥科普 浏览 1982 次 发布时间:2022-06-21
许多人都有这样的经验,在常温状态下,无论是你将油倒入水里,还是把水倒进油中,它们并不会互相融合成为某种稀释的溶液,而是很快地分开,形成一个明显的界面。这究竟是为什么呢?
有人说,这是因为油比水轻呀!所以油就浮在水的上面。这显然站不住脚,因为酒精也比水轻,但它能与水完全溶合;同时尽管绝大多数的油密度低于水,但这却不是二者互不相溶的真正原因。从科学的角度来看,两种液体是否相溶与它们的比重无关,而与它们的分子极性密切相关。

利用水油分层制成的液体“沙漏”,有颜色的是水
分子之间的力
液体分子之间通常存在两种相互作用力:范德华力和氢键,这两种力使分子之间相互吸引又保持一定的距离,它们是由分子的化学电性质决定的。
我们知道分子内部各原子之间通常以共价键或离子键相结合,这是由原子之间电子的共享与交换引起的力,这种电磁力通常比较强、作用距离也很短,你要是想把一个分子拆开来需要消耗比较大的能量。
分子与分子之间的范德华力是弱化学力中最弱的一种,其强度在0.4~4kJ/mol之间。当两个原子间距离大于0.6nm时,我们不足以观察到范德华力;同样,当原子间距离小于0.4nm时,力就会排斥。

壁虎是依靠范德华力在墙壁上爬行的
水由氢和氧原子组成。当氢(H)原子与氧(O)、氮(N)或氟(F)结合时,氢唯一的一个电子会与它们形成共价键,这时候氢原子的电子由于被O、N或F吸引而稍稍“跑偏”,导致氢原子这一端呈现更多的正电性(氢原子核带正电);与之相对应地,分子的另一端会因为吸引电子的能力更强而显示出负电。分子对外显示出比较强的电极性,分子与分子之间会因为电极性的不同而相互吸引。
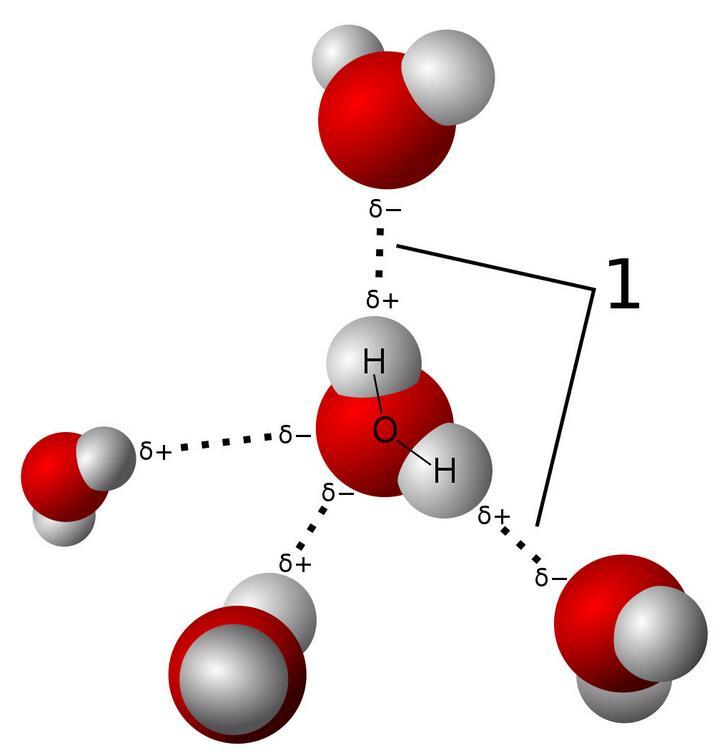
水分子间通过强大的氢键连接
氢键的极性很强,当分子之间通过氢键相互吸引时,它的能量通常比范德华力要大许多倍。这正是水相比于其它液体拥有多种独特性质的原因。

氢键是水表面张力的重要原因
分子的极性
每一种原子的原子核吸引电子的能力都不相同,当这些原子通过共价键相互结合成分子时,电子的运动轨迹会更偏向于那些吸引力更强的原子,这就造成了分子拥有一定的极性。分子的极性是分子间相互作用力的重要因素之一。
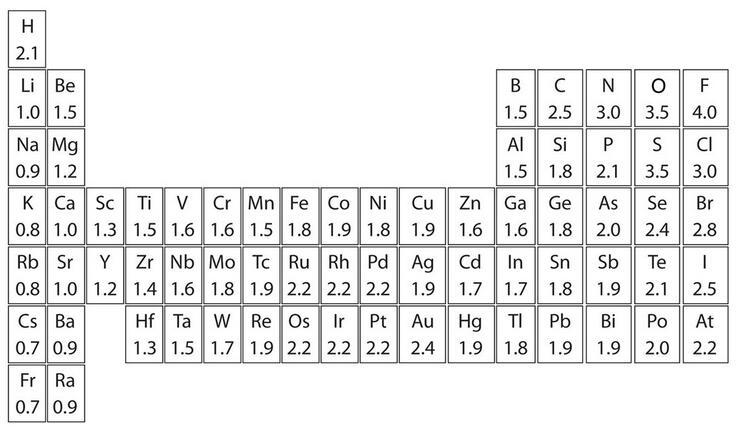
元素的电负性用来确定共价键的极性
上图是元素周期表中部分元素电负性的标量,电负性是一个无单位数,数字越高,原子吸引电子的能力越强。我们可以通过确定参与共价键的两个原子的电负性的差异来判断共价键的极性:
当分子中两个原子电负性的差异为0时,原子之间为非极性共价;
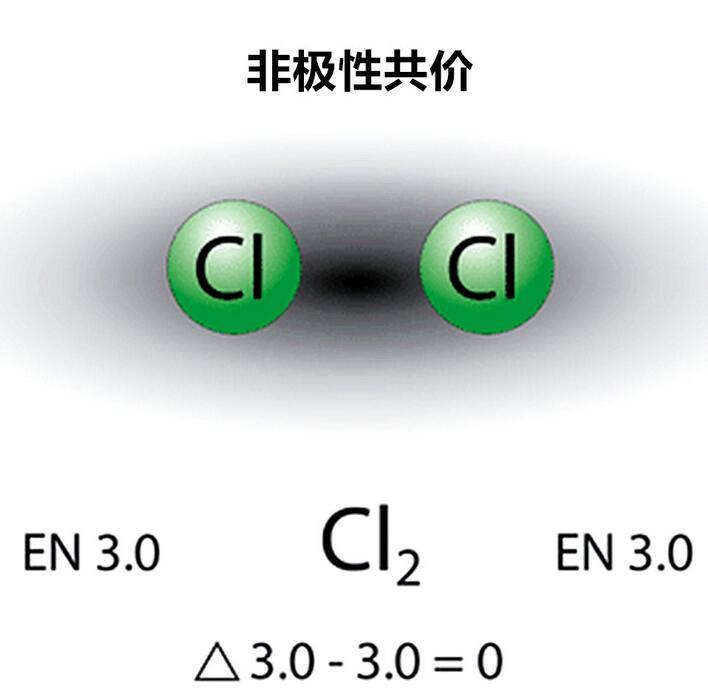
氯分子的非极性共价
当电负性差异的值为0~0.4之间,共价是弱极性的,分子对外依然显示非极性的特征;
当电负性差异的值为0.5~2.0之间,原子间为绝对极性共价;
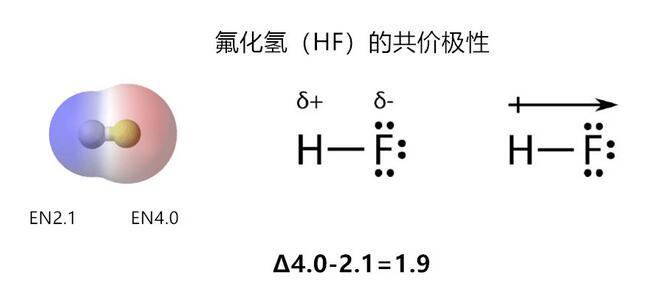
氟化氢分子有很强的极性
而当这个值>2.0时,原子之间就是离子键合而非共价键了。食盐(NaCl)就是离子键,因为Na的电负性为0.9,而Cl的电负性是3.0,二者的差值3.0-0.9=2.1>2.0,因此食盐很容易溶于水。
当两个原子间由极性共价关系相结合时,分子的一端会稍稍显示出正电荷,而另一端相应带负电荷,这种分子有两个相反的电“极”,因此我们称之为偶极子。
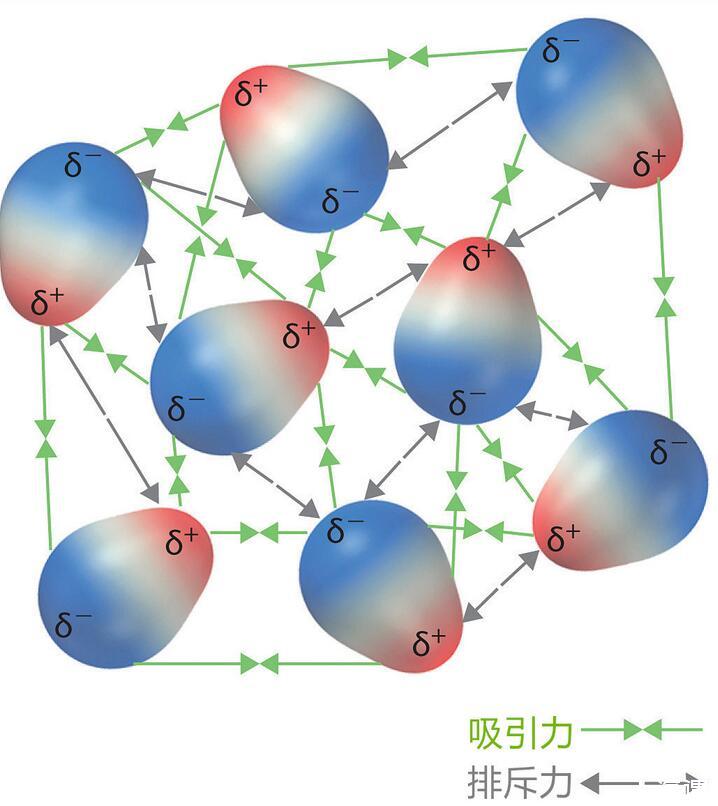
液体偶极子之间力的平衡关系
如果分子是由两个以上原子组成,在确定分子是极性还是非极性时,还必须考虑分子的几何形状。下图显示了二氧化碳分子与水分子之间的比较,二氧化碳是线性分子,偶极子因强度相同方向相反而互相抵消,对外显示整体分子的极性为零;水分子的两个极性键有夹角,因此整体对外显示出极性。
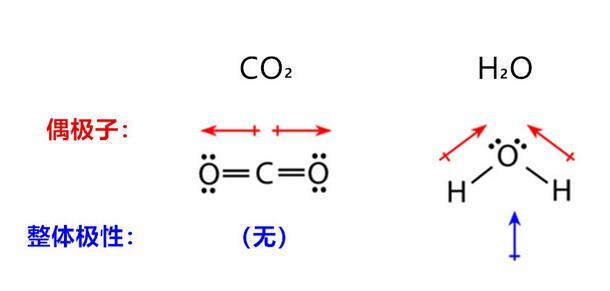
二氧化碳与水分子的极性
非极性分子间的力
非极性分子之间没有强大的氢键结合,那么它们是如何相互影响的呢?
前节介绍了氯气分子和二氧化碳分子,它们都是非极性的。对于由更多原子组成的一些分子,由于组合几何结构的关系,它们也往往对外显示出极性或非极性。比如三角形平面排列的三氟化硼和四面体排列的甲烷,它们都是非极性分子,因此不会产生整体偶极子。
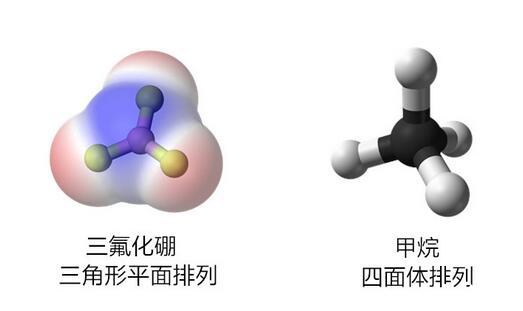
对称排列不会产生整体偶极子
非极性分子是通过伦敦分散力进行结合的。伦敦分散力简称“伦敦力”,它是指非极性分子内部由于电子移动产生的瞬时偶极诱导的偶极力。伦敦力是范德华力的一部分,因此它并不与范德华力相矛盾。
非极性分子尽管整体上对外不显示极性,但它内部电子在运动的过程中会因为移动位置的原因产生某些瞬间的不平衡,这种内部电荷的不平衡状态反应到整个分子上,就使得分子在某些瞬间产生整体的偶极性。当一个分子出现瞬间极性时,它会感应附近的分子,使之电荷相反,从而实现互相吸引。由于伦敦力的相互吸引作用很弱,导致非极性分子的间距较大,油大多由非极性分子组成,因此油的密度普遍比水低,它会浮在水的上方。
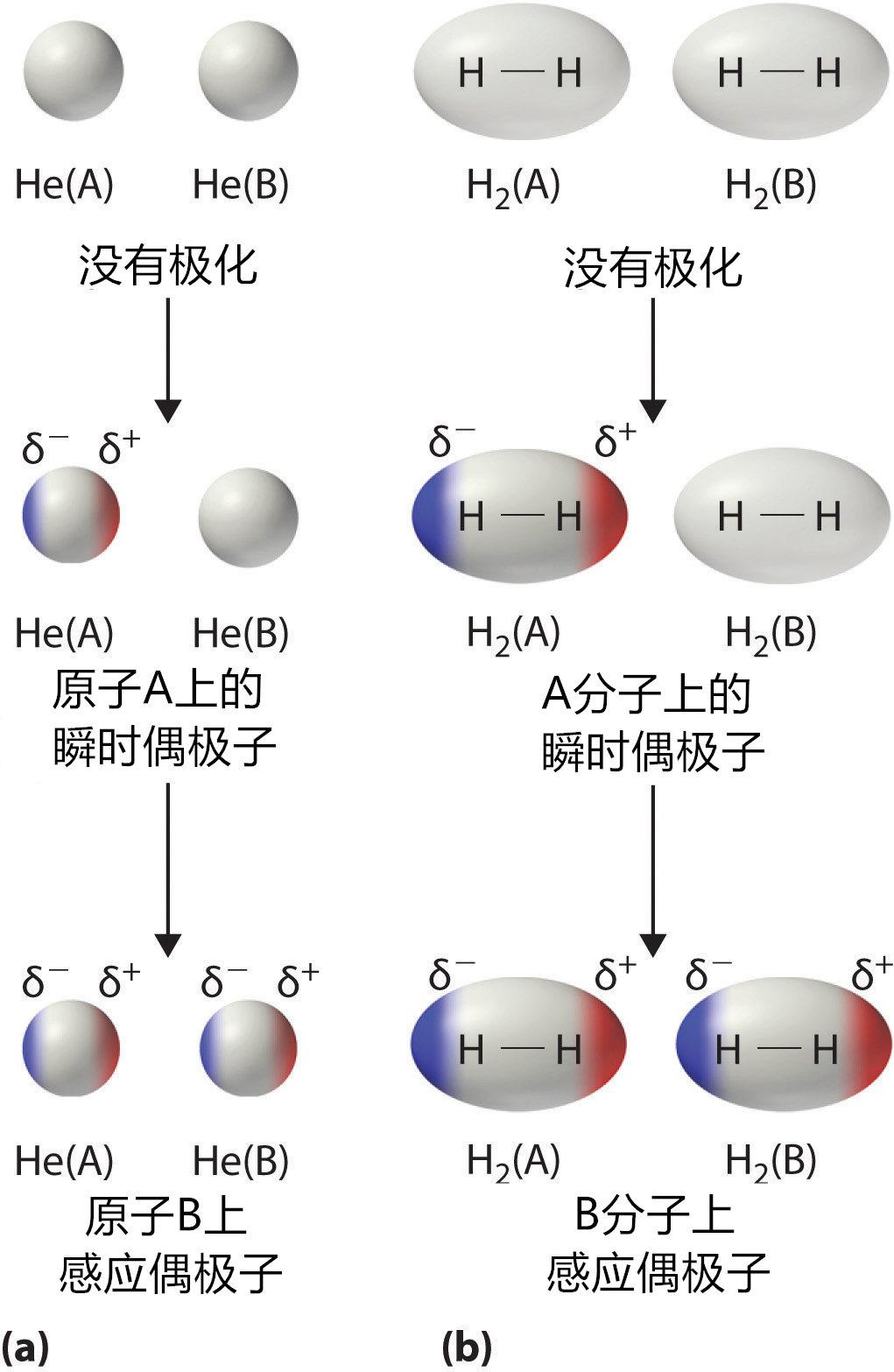
非极性分子感应偶极子产生伦敦力
水油不混溶的原因
通过前面的介绍,我们了解了:
水分子由于氢氧共价键是偶极子,同时两个氢氧键之间存在夹角,所以水分子是偶极子。
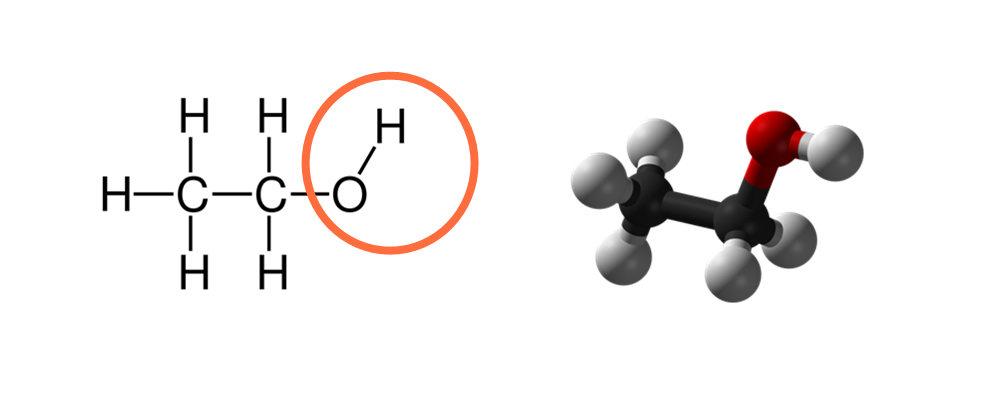
乙醇含有一个羟基(OH)因此它溶于水
水分子通过氢键互相连接形成大的水分子团,氢键比范德华力更强大,所以水分子会首先与相邻的极性分子相互吸引并结合,从而形成表面张力。水可以接纳其它同样极性分子基团(例如OH、NH基团),但对非极性基团具有排斥性,它会拒绝其它分子特别是非极性分子加入,因此水显示出对非极性物质(例如油)的排斥力。

将染色的油倒入水中,它们会很快分离
油大多含有CH键,CH键极性很弱(<0.4),因此它是疏水性的。水分子会首先与附近其它亲水基团相结合形成氢键或离子键,而在水分子与油的分子之间仅存在微弱的感应电荷和范德华力,加之二者的密度不同,水与油不仅不会相互溶合,还会出现分层现象,我们可以很容易将其分离开来。

分液漏斗是实验室中常见的油水分离装置










