合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(四)
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(三)
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(二)
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(一)
> 新型多羟基苯磺酸盐驱油剂的界面张力优化及油田应用潜力分析(三)
> 新型多羟基苯磺酸盐驱油剂的界面张力优化及油田应用潜力分析(二)
> 新型多羟基苯磺酸盐驱油剂的界面张力优化及油田应用潜力分析(一)
> 基于最大气泡压力方法测量液态锂锡合金表面张力
> 烷基糖苷表面活性剂界面张力与润湿性相关性研究(二)
> 烷基糖苷表面活性剂界面张力与润湿性相关性研究(一)
蛋白质外聚物中多糖的比例——结果与讨论
来源:上海谓载 浏览 3075 次 发布时间:2021-10-12
三、结果与讨论
3.1. 表面张力与蛋白质的关系:多糖比 在中观实验中
使用 EPS 胶体分数,SFT 张力测量来自 三个中宇宙实验比较海水和两个沿海 水域如图 1 所示。 表 1 总结了三个中宇宙实验的参数。我们发现海洋雪和 在 Control、WAF 和 DCEWAF 中观察到海洋油雪 (MS/MOS) 沉积,而 CEWAF 有混浊的悬浮液, 最后一天只有稀疏的沉积物(Xu et al. 2018a)。 为了 开阔的海洋条件(第 4 天,用营养物质修正)和第 2 天 沿海水域(第 3 天,用微生物浓缩物修正;第 4 天, 用营养素修正)在图 1 中,SFT 的趋势与 蛋白质:多糖比例的函数,均取自 来自水柱的 EPS 胶体。 EPS胶体组分用于 不同的中观实验集中在 8.3 倍 用微生物浓缩物修正沿海水域的中宇宙; 25 在广阔的海洋中的中宇宙时代; 而不是集中在 沿海水域的中观生态系统被养分修正。
CEWAF 在水柱中保持含有油滴的胶体材料的乳液。 虽然 CEWAF 治疗 导致更稳定的乳液,它们的酶促作用(Kamalanathan 等。 2018), MOS沉降效率, 通过碳评估 质量平衡和 14C 分析(Xu 等人,2018a)、多样性和 丰富的浮游植物(Bretherton 等人,2018 年); 在正烷烃和生物标志物比较中观察到的生物降解程度(Wade 等人, 2017); 在这些实验的持续时间内,分子组成的氧化变化(Hatcher 等人,2018 年)似乎都大大减少了。
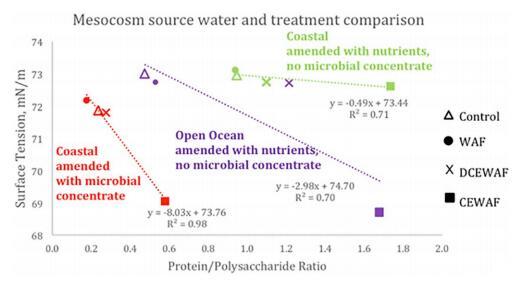
图 1. SFT 与蛋白质多糖比的比较 (蛋白质:多糖)在开阔的海洋与两个沿海环境中。 这 蛋白质:多糖的所有环境的处理都显示出类似的趋势 其中 CEWAF > DCEWAF > WAF ≥ Control 并且 SFT 的趋势是 与此模式相反。 每个数据点是一式三份的平均值(3 个独立的 每次治疗的中胚层和 5 次 SFT 测量值 < 0.30 mN/m CEWAF 的标准偏差,其他处理的标准偏差 < 0.05 mN/m)。
EPS 胶体溶液的 SFT 与 蛋白质(更疏水)到多糖(更亲水) 集中度,可以作为整体的相对度量 胶体部分的疏水性。 此外,图1中的数据 意味着石油和/或 Corexit 的存在导致增强 EPS 胶体的蛋白质:多糖比率,但降低了 胶体部分的 SFT。 CEWAF 中蛋白质含量较高 处理对应的细菌计数高于其他处理 治疗(Kamalanathan 等人,2018 年;Doyle 等人,2018 年)。 DCEWAF 还具有更高的蛋白质含量和更高的蛋白质:多糖 比 WAF 和对照处理。 值得注意的是,当 与不同的中宇宙实验相比,开阔的海洋中宇宙的油浓度高两倍,相对 DCEWAF 处理中的 Corexit 含量较高,即它们仅 ~6.3 倍稀释的 CEWAF,而 DCEWAF 处理来自 用微生物浓缩物修正的沿海水域约 15 倍 稀释的 CEWAF 和经过修正的营养物质的沿海水域是 ~ 10 倍稀释的 DCEWAF(表 1)。 因此,趋势线的斜率 可能受到 DCEWAF 中 Corexit 数量的影响,并且 CEWAF 处理 SFT 和蛋白质:多糖 比率。 由于其表面活性剂特性,Corexit 降低了 SFT,但它 还增强了蛋白质的产生,导致比对照和 WAF 处理更高的蛋白质:多糖比率。 这 相对 SFT 和蛋白质:对照和 WAF 的多糖位置 可能是由胶体和海水的组成和浓度的微小差异产生的。
为了测试我们的初始 SFT 测量的可靠性 每个中宇宙的源水,SFT 的关系由 沙卡维等人。 (2010) 可以使用:
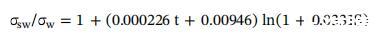
其中σsw为海水的SFT,σw为纯水的SFT,t为 温度(°C),S 是盐度(g/kg),源的 SFT 以下中宇宙的水域计算为每个为 73.35 mN/m 中宇宙基于表 1 中给出的盐度,温度为 22.8 °C,纯水 SFT 为 72.6 mN/m。 采取 我们给出的线性关系的 y 截距值的平均值 图 1 中的每个中胚层,初始值都在 < 2% RSD 内 来自计算的 73.35 mN/m 值。 然而,这个计算值 用于不含EPS胶体的海水,它甚至可以改变SFT 低浓度时,以及 WAF 和 西瓦夫。
从图 1 中可以明显看出,在 EPS 胶体部分中, 蛋白质:多糖比率与海水中的 SFT 相关。 这个 pH ~ 8 高于大多数蛋白质的 pI(pI 是等电点, 这是分子上的净电荷为零时的 pH 值)。 在 在海水 pH 值下,氨基酸的羧酸位点处于解离形式,氨基带正电荷为 R-NH3+。 因此,蛋白质与酸性多糖之间的相互作用 由阴离子反应位点之间的相互作用控制 多糖和蛋白质的小阳离子反应位点, 导致形成可溶性阴离子"蛋白质-多糖"聚集体(Ghosh 和 Bandyopadhyay 2012)。 这些多糖蛋白复合物表现出广泛的特性,包括它们的 稳定空气-水或油-水界面的能力,以及增粘和 胶凝特性(Ghosh 和 Bandyopadhyay 2012)。 的稳定性 当通过以下方法稳定时,油乳液液滴预计会更高 与其他表面活性剂相比,蛋白质-多糖复合物 分子或颗粒,或多糖或单独的蛋白质(Tcholakova 等。 2008)。 此外,蛋白质倾向于通过在液滴周围提供更厚的层和更大的表面覆盖来稳定乳液 界面面积,从而减少奥斯特瓦尔德熟化过程(即, 小尺寸油滴的消失以更大尺寸的油滴为代价 液滴形成)在蛋白质稳定的乳液中。
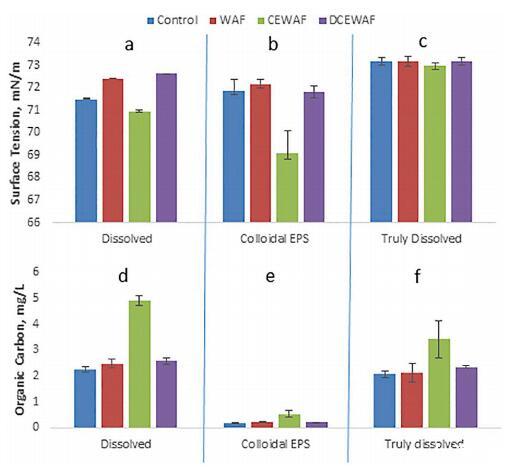
图 2. 使用沿海水域的中宇宙实验中的尺寸分数数据 用微生物浓缩物修正。 上面板显示了 SFT 沿海中观处理,按大小分数分组,来自水体 样品。 a) < 0.45 μm,其中颗粒已被过滤掉,b) EPS 胶体部分(< 0.45 μm 和 > 3 kDa,8.3x 浓缩),和 c) < 3 kDa 的"真正溶解"部分。 下面板表示有机 相同尺寸部分的碳,d) DOC,溶解的有机碳,e) 胶体有机碳,和 f) 真正溶解。
虽然我们的讨论集中在蛋白质和多糖的非共价相互作用上,但蛋白质和多糖之间的共价键 当天然状态作为蛋白聚糖存在时,多糖存在 或糖蛋白。 此外,共价交联可以通过 UVB 和 ROS 效应(Sun 等人,2017 年)。 之间的共价键 蛋白质中谷氨酰胺的羧基和赖氨酸的氨基 也可以通过微生物释放转谷氨酰胺酶形成分子(McClements 2011)。 所有共价键合过程都会 促进 EPS-Corexit-油-水乳液的稳定性。
3.2. 中观实验中尺寸分数的表面张力
不同尺寸的 SFT(图 2a、b、c)和有机碳(2d、2e、2f) 最后一天水柱样品中的馏分和处理 中宇宙实验的结果,使用经过修正的沿海水 沿海微生物浓缩物。 尺寸分数是溶解的 (≤0.45 um 部分,没有操作定义的颗粒),EPS 胶体相(≤0.45 um and ≥ 3 kDa),真正溶解的 (≤3 kDa) 不含 EPS 胶体。 顶部面板显示 SFT 测量值,下面的面板是有机碳浓度,和 对应测量的三个尺寸分数对齐 垂直。 所有处理,Control、WAF、CEWAF 和 DCEWAF,都是 代表。 图 2a 和 c 所示的样品直接来自 mesocosm,而图 2b 的胶体部分浓缩了 8.3 次。
SFT(图 2)结果表明 EPS 胶体相是 导致 SFT 变化的尺寸分数。 这个观察 取自 2c,其中真正溶解的尺寸分数是一致的 ~73.2 mN/m at 所有处理。 此外,变化较小 溶解部分是 EPS 胶体部分与 真正解散了。 单向方差分析用于评估潜力 图 2a 和 b 中处理之间的差异,溶解和 EPS 胶体部分之间的差异。 方差分析在 alpha 下运行 0.05 的水平。 对照 SFT 值显示无显着差异 (p = 0.26) 在图 2a 的溶解 (< 0.45 μm) 部分和图 2b 的 EPS 胶体部分之间。 然而,有一个显着的 图 2a 和 b 中相同尺寸分数之间的差异 其他处理,如 WAF、CEWAF 和 DCEWAF,分别为 0.002、0.006 和 0.016。 这些 结果是值得注意的,因为它们表明浓缩的 EPS 胶体影响了控制中水的分子间作用力 在 SFT 中与未集中的那些没有太大区别 无颗粒的溶液。 然而,其他治疗方法 WAF, CEWAF 和 DCEWAF 之间具有更强的分子间作用力 EPS胶体部分表面的分子比溶解部分的分子多。 这强烈表明 EPS 胶体分数 与溶解部分相比,对 SFT 的影响更大。
图 2 中的有机碳表明大部分溶解的 部分,图 2d,由低分子量碳组成,因为总溶解部分,图 2f,几乎等于 有机碳浓度中的溶解分数。 胶体 馏分(图 2e)表明超滤已去除了 85% 到 95% 的 溶解部分的有机碳。 这可能表明 5% 到 15% 的 CEWAF 可能保留在 EPS 胶体部分中, 表明 SFT 的降低(图 2b)也受 Corexit 的影响 和 WAF。 然而,使用 SFT 与 Corexit 浓度数据, 图 4b,即使是 15% 的 Corexit 也无法解释 在图 1 的 CEWAF 处理中测量的 SFT 降低。
3.3. 使用显微镜观察界面(空气/水)相互作用 模型分子的混合物显示在空气-水中富集的蛋白质 界面
四种治疗的共聚焦激光扫描显微镜 (CLSM) 带有模型 EPS 组件的处理如图 3 所示。 ASW 显示在左侧 BSA 的 0.1% 垂直系列溶液中 右边是一系列 0.1% 的海藻酸溶液。 横向, 面板显示了 Corexit、CEWAF、WAF 的相应处理, 和对照,用于 BSA 和海藻酸溶液。 绿色荧光探针 CTC 突出显示与阴离子结合的亲水性 Ca2+ 多糖和蛋白质的区域。 对于海藻酸和 BSA实验,单独使用Corexit就可以分散模型分子 无界面积聚。 图像也显示出明亮密集 微聚集体中较高倾向的绿色荧光 Corexit 比在其他治疗中看到的要多。 海藻酸面板全部显示 聚集体的分散,而 BSA 面板显示主要在界面处的蛋白质。 CEWAF 海藻酸和 BSA 可以生成 清晰的界面层。 CEWAF 中的 BSA 显示聚合 当它们向上扩散时在垂直方向上被夸大 随着图像曝光的时间。 此外,BSA CEWAF 显示聚集体似乎在液体表面上方,因为它们是 在未显示的泡沫层之内和之上。 具有主要亲水部分的控制处理表现出较少的分散 和不太明显的界面层。 虽然垂直尺度较小 对于 BSA 图像比对于海藻酸图像,仍然很明显 海藻酸分散在整个体积中,而 BSA 迅速扩散到界面。 唯一的例外是 Corexit 处理显示没有界面积聚和完全分散 海藻酸和BSA。
相同放大倍数下 BSA 聚集体的 SEM 图像(图 3b) 在 Corexit(左)和 ASW 中用 0.1% BSA 溶液制备 来自与图 3a 中相同的溶液的对照处理(右)。 这 Corexit 处理(左图 3b)显示来自液体的微聚集体 阶段。 对照处理(图 3b 右)显示了一个大结晶 蛋白质聚集体。 图 3a 和 3b 中描绘的结果支持 静电相互作用和共价键作用的重要性 在微聚集体形成中(Corexit 与 Ca2+ 离子突出显示 CTC) 和 Ca2+ 螯合中的配位共价键 CTC 和阴离子亲水部分(CEWAF、WAF 和对照 处理)形成比 Corexit 更少但更大的聚集体 治疗。
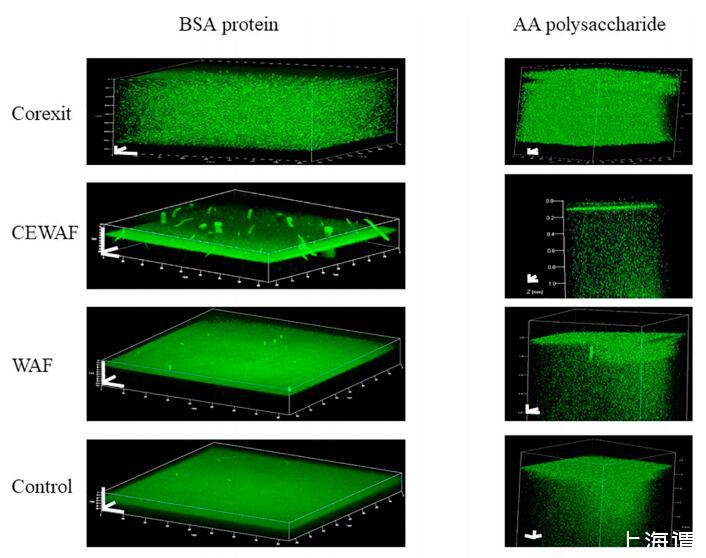

图 3.a. 使用氯四环素 (CTC) 荧光探针染色的 CLSM 图像在不同处理中的空气/水界面关系 多糖和蛋白质的亲水性 Ca2+ 结合阴离子区域。 垂直面板组在左侧代表 0.1% BSA 蛋白和 0.1% 右侧的海藻酸 (AA),每个都在 ASW 中。 水平面板组比较了不同处理中的 BSA 和 AA 溶液。 比例尺表示 每个方向 100 μm。 湾 BSA 的 SEM 图像 在相同放大倍数下聚集显示 比例尺为 3 μm。 总量来自 0.1% Corexit 中 ASW 中的 BSA 解决方案,左侧和 BSA 中 控制治疗,对。 两幅 SEM 图像均来自 相应的解决方案如图 3 所示。 Corexit 处理显示分散的微聚集体 来自水相。 控制处理 显示大的结晶蛋白质聚集体。
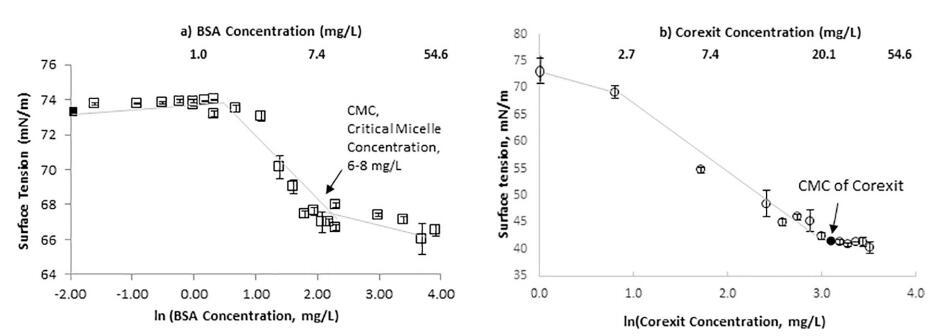
图 4.a) 显示了海水中模型蛋白质的 SFT 作为其浓度自然对数的函数。 BSA 蛋白的 CMC 为 6–8 mg/L。 b) 显示 Corexit 的 CMC 浓度为 22 mg/L。
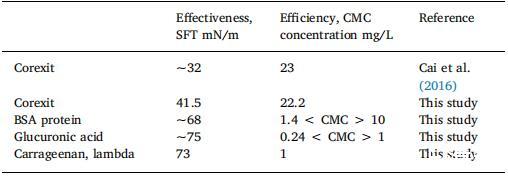
表 2 SFT 和 CMC 比较模型蛋白质和酸性多糖。 虽然Corexit 更有效地降低 SFT,EPS 模型成分更有效 因为需要低得多的浓度才能开始乳化(蛋白质)和 稳定成分(酸性多糖;结合大分子并添加 粘度)。
3.4. 临界胶束浓度的表面张力测量 模型生物分子
EPS 包括各种蛋白质和酸性多糖,因此 SFT 可以 用于对模型蛋白和多糖进行 CMC 测试。 在 图 4a,BSA 的 CMC,一种分子量为 66 kDa 的小而稳定的中等非反应性蛋白质,因其缺乏作用而经常使用 在许多生化反应中)的 CMC 为 6–8 mg/L,SFT 为 68 毫牛/米。 图 4b 显示了广泛使用的分散剂 Corexit 的 CMC 在深水地平线马孔多漏油事件中。 表 2 比较 模型分子和 Corexit 的有效性和效率 降低表面张力。 就表面活性分子而言,效率随着形成表面活性剂所需的表面活性剂浓度而增加 CMC是最低的。 然而,表面活性剂的有效性 当它在更大程度上降低表面张力时更高。 这 商业分散剂 Corexit 更有效但效率较低 比 EPS 成分降低 SFT(表 2)。 所以,Corexit 有效 当它位于 CMC 时,将 SFT 降低到大约 42–32 mN/m。 蛋白质 BSA 和酸性多糖(带有羧基部分的葡萄糖醛酸; 带有硫酸根的角叉菜胶是 EPS 的两种典型成分), 在促进胶束的两亲分子自组装方面非常有效。 虽然模型组件并没有降低表面张力 作为 Corexit,它们在形成小于 2 倍的胶束时更有效 Corexit 达到 CMC 所需的浓度。
3.5. pH变化对模型生物分子表面张力的影响
葡萄糖醛酸,一种酸性多糖,在低浓度下降低 SFT 浓度,符合预期。 然而,BSA 蛋白会导致增加 在低浓度的 SFT 中(图 5)。 据我们所知,文献中尚未记录生物聚合物的这种效应。 在这种情况下 BSA,低浓度乳化剂或表面活性剂,标准免费 气水界面的能量经历熵的增加,因为 分子的疏水部分从水性 相到空气。 在重新定向疏水性尾部的过程中 分子进入空气,有序的水分子的壳 尾部周围被喷射到大量水相中。 随着不利的熵增加,SFT 增加。 然后随着 乳化剂/表面活性剂分子在表面的浓度, 较高的熵消散并且表面张力降低(Angarska 等。 2004; Warszynski 等人。 1998年; Wang 和 Yoon 2004)。 这种效果 当生物聚合物的含量低到可以忽略不计时 疏水性,如葡萄糖醛酸的情况。
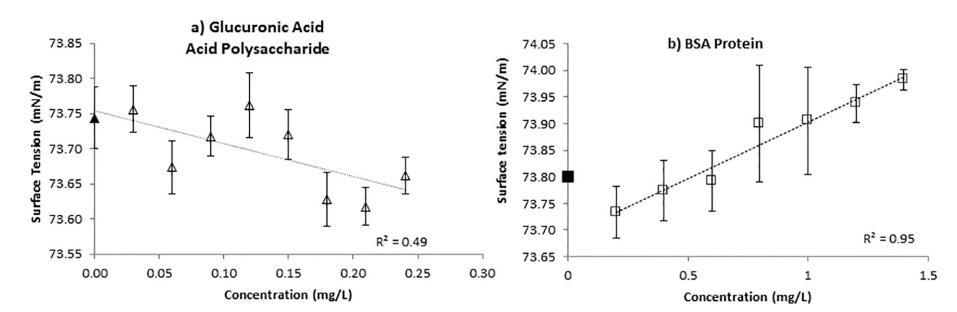
图 5.a) 葡糖醛酸,一种酸性多糖,证明在低浓度下 SFT 降低。 b) 相反,BSA 蛋白在低 专注。 然而,BSA 在较高浓度下再次降低。 低浓度下 SFT 的这种增加可以通过水中 pH 值的降低来解释 由 BSA 引起,图 6。
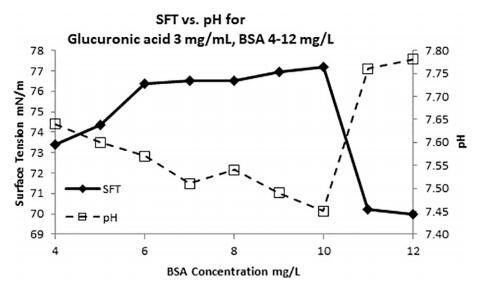
图 6. 改变 BSA 蛋白的溶液中糖醛酸(葡萄糖醛酸)浓度为 3 mg/L 时的 SFT(菱形)和 pH(空心方块) 浓度。 CMC,临界胶束浓度,在 BSA 浓度为 10 mg/L + 3 mg/L 葡萄糖醛酸。 pH 值变化约 0.3 个单位 SFT 范围为 7 mN/m。
尽管有海水的缓冲能力,但图 6 中的数据显示 由 < 1 pH 的生物分子的酸度引起的 pH 变化 单位与 SFT 的变化呈负相关。 这表明即使 pH 值的微小变化可能是胶束形成的重要因素 (CMC 浓度,~10 mg/L BSA + 3 mg/L 葡萄糖醛酸,图 6)。 此外,在较低的 pH 值下,有较高浓度的游离 氢离子导致氢键的电位增加。
这些结果的重要性在于,即使在小范围内, pH 值的变化可能会影响分子间的电荷关系和 诱导分子自组装。 钦等人。 1998年指出钙 由于唐南效应,内部凝胶可能会过饱和,例如 pH 值的轻微增加不会导致结晶 海水会导致凝胶内沉淀,特别是在 具有高生产力的微环境。










