合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 界面流变仪可以测量液体表面张力吗?界面流变仪与界面张力仪区别解析
> 测量表面张力/界面张力的仪器有哪些?怎么选
> PG脱酰胺添加量对玉米醇溶蛋白气-水动态表面张力的影响
> 芬兰Kibron表面张力仪使用指南【专业版】
> 平面流动皂膜表面张力系数、厚度和流动速度实验装置及测量方法(二)
> 平面流动皂膜表面张力系数、厚度和流动速度实验装置及测量方法(一)
> 单层膜界面上亚微米颗粒表面张力阻力系数修正——颗粒在单层膜上的阻力系数
> 单层膜界面上亚微米颗粒表面张力阻力系数修正——膜的性质及实验方法
> 单层膜界面上亚微米颗粒表面张力阻力系数修正——摘要、引言
> Kibron超微量天平在生物医药研究领域应用实例
应用不同组装的磷脂酰胆碱对牛精浆蛋白的隔离——结果与讨论
来源:上海谓载 浏览 1461 次 发布时间:2021-10-20
三、结果
3.1. 精浆的界面特性
精浆 SDS-PAGE 电泳显示 存在一系列 14 至 120 kDa 的多肽 具有不同的比例(图 1),与之前的研究结果一致 [37]。 14 至 5 个主要频段的比例 在泳道 4 上估计为 30 kDa。
在大约 16–17 kDa(74% 强度)。 它们被归因于 BSP1 和 BSP3 [12]。 在约 28 kDa (9%) 处检测到第二条带 对应于 BSP5 [12]。 BSP1、BSP3 和 BSP5 的集合代表了精液中所含最小多肽的 83%。 血浆(在整个提取物中约占 65% [17])。 另一个乐队是 检测到 22 kDa (4%) 和一个在 14 kDa (13%) 对应于 一种核糖核酸酶 [22]。
通过跟踪精浆水溶液的表面张力来突出这些组分的表面活性 (图 2)与浓度(Gibbs 膜)。 的表面张力 新鲜样品被证明相对较低 (47 mN/m) 并且增加了 因为样品被稀释了。 表面张力值等于纯缓冲液-空气界面的值 (72 mN/m)。 1/100000 的大稀释。 因此,精浆显示出显着的表面活性:首先,新鲜样品的表面张力 (47 mN/m) 与众所周知的表面活性蛋白(如牛血清白蛋白 [38] 或溶菌酶)获得的值一样低 [39]其次,表面活性仍然存在于大范围内 浓度范围(需要稀释 100,000 以去除 它)。 除此之外,还分析了表面膜的稳定性 通过执行朗缪尔薄膜在空气 - 缓冲界面处。 薄膜的压缩等温线(图 3)显示出显着增加 分两步从 0 到 35 mN/m 的压力。在 18.9 mN/m 时,有 是与空气-缓冲液界面处分子构象变化有关的斜坡破裂。 压缩能力 膜在升高的压力下(大约与生物膜相关的压力,25 mN/m)显示出膜的高稳定性 由血浆精液成分形成。
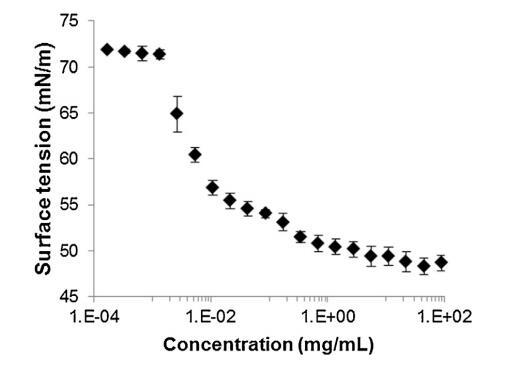
图 2 牛气水界面表面张力(±标准差) 精浆溶液中所含蛋白质浓度的函数 提取并以对数刻度表示 (T = 23.2 ◦C ± 0.3 ◦C, n = 2, 4 次重复 每个样品)。
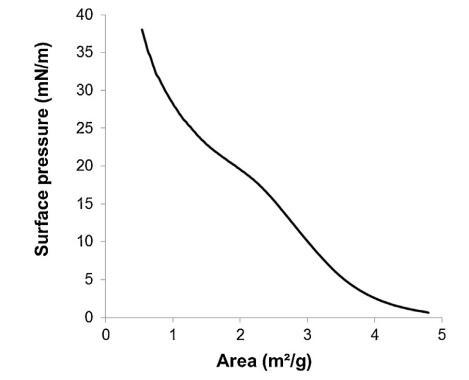
图 3. 表面压力-面积 (?-A) 等温线形成于 通过传播精浆形成空气/缓冲液界面(n = 3,标准偏差 在 0-18.9 mN/m 范围内不超过 1.5 mN/m,在 1.2 mN/m 范围内不超过 18.9–38 mN/m)。
3.2. 低密度脂蛋白和脂质体对仿生外传单的作用 精子膜
低密度脂蛋白和脂质体引入亚相的影响 精子膜仿生外叶的示意图 在图 4. 对于控制测量(没有注入任何保护剂,设计为图 4 中的 M),表面积略有下降 随着时间的推移。 当低密度脂蛋白被注射到低于 重建的外叶(图 4 中的 M/LDL 曲线),它导致了 表面积的快速和大量增加。 相比之下,注入 脂质体(图 4 中的曲线 M/C4)几乎没有改变薄膜压力 单层与参考单层的比较(曲线 米)。 脂质从脂质体中掺入的动力学 单层比低密度脂蛋白要慢得多。 因此,有一个弱 在时间尺度上脂质体在空气-水界面的吸附 对应于精液的制备。
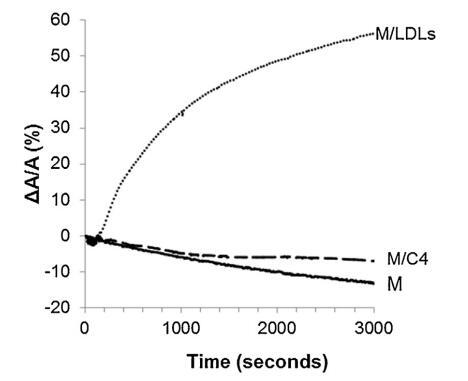
图 4. 被覆盖的界面的相对表面积随时间变化 单层 (M) 以 25 mN/m 压缩并在含有 (——) 没有额外的分子,(...) LDL(4.6 毫克 PC)和(—)脂质体 C4(含有 4.8 毫克 PC)。 空气-缓冲液界面的温度为 34°C。
在低密度脂蛋白的情况下,注射的磷脂酰胆碱的量 根据低密度脂蛋白的组成,估计为 4.6 毫克 [33]。 在脂质体的情况下,分散体含有 6.55 ± 0.02 mg 脂质,即 4.8 毫克磷脂酰胆碱。 大幅增加 在重建的外层下注射低密度脂蛋白后的表面积 精子膜的小叶可能与精子的能力有关 低密度脂蛋白在空气-水界面处自发吸附和扩散 [33]。 界面处低密度脂蛋白的容易破坏可能会释放 具有表面活性的磷脂和蛋白质以及不溶的甘油三酯 [33]。 在脂质体的情况下,平衡 双层形成磷脂和单层形成磷脂之间 磷脂取决于链不饱和度、链长和 极性头基 [40]。 考虑鸡蛋的主要成分 卵磷脂 (PC 74%) 及其脂肪酸组成 [41],有 大约 48% 的饱和 PC 和 52% 的不饱和 PC。在这项工作的温度下,饱和 PC 没有熔化,可能不会 在界面处扩散,而不饱和的则远远超过 它们的熔化温度并可能扩散。 在剩余部分 PE (11%) 中,双层和单层形成之间的平衡 磷脂与磷脂的结构密切相关 所以不能给他们下结论。 因此,不存在 基本解释。 鸡蛋脂质体缺乏吸附可能 可以解释为它们的传播以前已经 在自由界面上检查:单层已经存在于 界面可能会限制基于磷脂的脂质体的扩散 在其他地方被认为是散装的高稳定性物体, 特别是当由磷脂酰胆碱组成时。
3.3. 通过低密度脂蛋白隔离精浆成分和 脂质体
当牛精浆 (SP) 被注射到 单层,分子面积的变化在一个 时间的函数(图 5 中的曲线 M/SP)。 表面积没有立即增加,而是在 150 秒后才增加,因为 脂质的界面。 它在 150 秒内达到最大值(300 秒后 注入)然后它稳定了 300 秒并随着时间的推移缓慢下降 (图5)。 表面积的快速增加揭示了良好的表面 SP 成分的活性(最有可能是蛋白质),如图所示 在图中。 2 和 3. 600 秒后表面积的减少为 与纯单层的速度相同。 因此,BSP 蛋白 吸附后留在界面上。
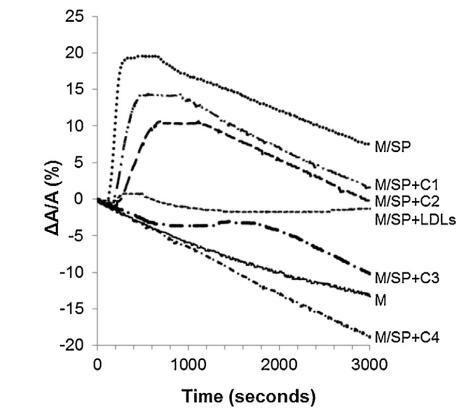
图 5. 被覆盖的界面的相对表面积随时间变化 单层 (M) 并在包含 (——) 的缓冲液上形成,没有额外的分子, 注射 (. . .) SP(26.6 ± 1.5 mg 蛋白质)后,SP(26.6 ± 1.5 mg 蛋白质)和不同浓度的脂质体 (— · · —) C1, (— —) C2, (- · —) C3 和 (- · -) C4(分别为 1.17 ± 0.02 mg、2.18 ± 0.02 mg、4.37 ± 0.02 mg 和 6.55 ± 0.02 毫克脂质)和 (- - -) 低密度脂蛋白(4.6 毫克 PC)和 SP 的混合物 (26.6 ± 1.5 毫克蛋白质)。 空气-缓冲液界面的温度为 34°C。 这 表面压力保持在 25 mN/m。
当低密度脂蛋白与牛精浆混合时 蛋白质重量比为 10:1 (BSP:LDLs) 并注射到单层下方,单层的分子面积随时间记录 几乎没有变化(曲线 M/SP + LDL,图 5)。 肩膀出现在 大约 400 s 揭示了 BSP 蛋白的弱吸附(这 肩部代表 M/SP 的 5%,上图曲线)。 然后,该 1000s后分子面积的变化减少并稳定。 不会像 M 和 M/SP 曲线的变化那样减少, 表明 LDLs 成分的吸附,与 它们在界面处的高扩散能力(曲线 M/LDL,图 4)。 因此,SP 中所含 BSP 蛋白在界面处的吸附 由于低密度脂蛋白而大大降低,并且 BSP/低密度脂蛋白的比率非常高 接近最佳值以完全防止 BSP 蛋白质影响单层。 磷脂酰胆碱注射量 根据低密度脂蛋白的组成估计为 4.61 毫克 [33]。 因此,注射了 4.61 mg LDLs 的磷脂酰胆碱 26.6mg精浆蛋白质,即1mg精浆蛋白质需要0.17mg磷脂酰胆碱。
脂质体(不同浓度)对 BSP 的作用 蛋白质也显示在图5中。 脂质体被引入 在进入亚相之前与精浆接触。 随着脂质体中浓度的增加(曲线 M/SP + C1 到 C4), BSP 吸附引起的表面积增加 蛋白质逐渐延迟和减少。当量 达到 4.37 mg (C3),仍有少量 BSP 界面处的蛋白质,由 1600 秒的肩部证明。 在 最高浓度 (C4),未掺入 BSP 蛋白 观察到,分子面积的变化甚至比对照曲线更负,表明 亚相中的膜组分。 因此,脂质体作用于 BSP 蛋白与 LDL 的作用方式相同。 最有趣的比例似乎介于 C3 和 C4 之间。 它是从 建立面积变化之间相互作用的曲线 和作为脂质体注射的磷脂质量(图 6)。 这 注入 26.6 mg BSP 的最佳质量为 4.6 mg,即 PC:BSP 比率为 0.16 (w/w)。
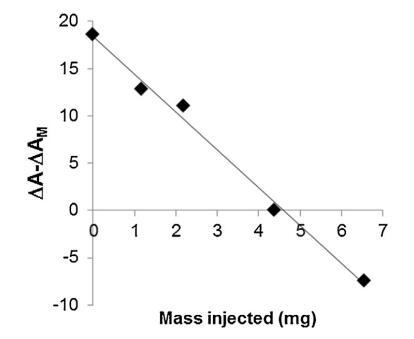
图 6. 相对面积随注射脂质体质量的变化 进入亚相。 线性回归是通过 R2 为 0.992 获得的。
3.4. 脂质体作用的显微镜评价 精浆
通过透射电子显微镜 (TEM) 检查脂质体或 LDL 与含有 BSP 蛋白的 SP 的混合物 并与对照进行比较。 对应的图片 无论放大倍数如何,精浆都没有表现出结构(图S1)。 相反,与低密度脂蛋白相关的结构 和脂质体很容易通过 (i) LDL 的致密和相当圆形的形状 (图 7A) 和 (ii) 圆形和有时 脂质体的多层结构(图 7B)。 在......的存在下 精浆,整组图像分析仍显示 圆形物体。 它们的大小平均与分析的相似 没有螯合剂(图S2)。 然而,在几个地方 在SP存在的情况下,一些大的圆形物体表征 通过(i)被厚层包围的原生结构(图7C) 低密度脂蛋白)或(ii)圆环内的致密核心(图 7D 与 观察到脂质体和图 S3)。 与图 7B 相比, 与精浆混合的脂质体系统地出现 比天然脂质体密度更大的核心。 这些新结构可能是由于渗透而导致膜破裂的结果。 BSP 蛋白进入界面层,导致 TEM 对比。

图 7. (A) LDLs、(B) 脂质体、(C) LDLs 和精浆(精浆中的比例为 0.17 mg PC/mg BSP 蛋白)和 (D) 脂质体和精浆的冷冻 TEM 图像 (精浆中 0.16 mg PC 脂质体/mg BSP 蛋白的比率)。
四、讨论
4.1. BSP 蛋白的表面特性及其可能 生物学作用
张力测定结果表明精浆中含有表面活性成分。 这些最有可能 蛋白质,因为它们构成了精浆的主要部分。 他们 由一系列亲水性和疏水性的 域 [5] 赋予它们两亲特性。 考虑到生物学背景,我们可以假设 BSP 蛋白可以 由于它们与 PC 的相互作用和它们自身的表面活性,到达被磷脂覆盖的界面。 这可以解释为什么 这个过程很快 [42]。将肽或蛋白质插入到 磷脂单层通常在流体域中进行 比压缩域更可压缩 [43]。 在 34°C,流体域由缩醛磷脂和不饱和磷脂酰胆碱组成 [35]。 因此,BSP 蛋白可以轻松穿透这些流体域,在那里它们可以立即相互作用 根据前面提到的涉及疏水腔的机制,使用含磷酸胆碱的分子 [11,12,34,42,44–46]。 BSP吸附量可能有限 通过流体域的可压缩性。 总而言之,BSP 蛋白一旦被吸附,就会保持锚定在界面上,这要归功于 它们的表面特性(我们的工作),构象重排 [47] 及其与膜成分的强相互作用 [48]。
4.2. 脂质体和低密度脂蛋白在 BSP 隔离中的效率 蛋白质
我们的结果表明脂质体与 LDL 一样有效 防止 BSP 蛋白到达界面,提供 使用正确比率的脂质体/BSP。 对于低密度脂蛋白,我们的模型表明 BSP/LDL 的比率 (10:1 w/w),常用于冷冻保存 非常接近完全阻止 BSP 蛋白的最佳值 从影响单层。 PC/BSP 与 PC 组织的比率 低密度脂蛋白中的 0.17 毫克磷脂酰胆碱对应 1 毫克精浆蛋白质。 同样,脂质体的最佳比例 PC/BSP 是 0.16 mg 磷脂酰胆碱用于 1 mg 精浆蛋白质。 知道鸡蛋中 PC 的比例可能取决于喂养, 低密度脂蛋白中 PC 的比例可能因批次而异,因此这些 比率被认为是相等的。 该比率与 LDL 或脂质体的隔离结构无关的事实表明 来自 LDL 的载脂蛋白不与 BSP 结合,尽管这 绑定是可能的 [26,49]。 更引人注目的是,这个结果表明 PC 组装为 LDL 中的单层或脂质体中的双层都没有影响。 在低密度脂蛋白的情况下,磷脂 占据外单层,所有这些都可以被 蛋白质。 相反,只有外叶的磷脂 形成单层脂质体的双层实际上是直接 与 BSP 蛋白接触。 由于络合比相同 脂质体和低密度脂蛋白,以及 PC 分子 (74%) 也构成内部 双层的小叶,这些小叶也参与 BSP 蛋白的复合。 符合BSP的轻松插入 蛋白质进入疏水膜,这些可以迁移 朝向内部小叶并引起一些破裂/融合 通过 TEM 观察到脂质体的双层。 尽管如此变化 低密度脂蛋白和脂质体的结构在 样品和 BSP 蛋白可以被认为主要锚定在 低密度脂蛋白和脂质体的表面。 在更高的脂质体:BSP 比率 与这里研究的相比,BSP1 是 BSP 中的主要蛋白质 家族诱导脂质囊泡的伸长和形成 向小囊泡进化的珠子项链状结构或 线状结构[50]。










