合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(三)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(二)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(一)
> 界面流变仪可以测量液体表面张力吗?界面流变仪与界面张力仪区别解析
> 测量表面张力/界面张力的仪器有哪些?怎么选
> PG脱酰胺添加量对玉米醇溶蛋白气-水动态表面张力的影响
> 芬兰Kibron表面张力仪使用指南【专业版】
> 平面流动皂膜表面张力系数、厚度和流动速度实验装置及测量方法(二)
> 平面流动皂膜表面张力系数、厚度和流动速度实验装置及测量方法(一)
> 单层膜界面上亚微米颗粒表面张力阻力系数修正——颗粒在单层膜上的阻力系数
产低温β-甘露聚糖酶的菌株O5提升低温油藏压裂液的破胶性能——实验部分
来源:应用化学 熊玉华, 周蕾, 杨世忠, 牟伯中 浏览 748 次 发布时间:2024-09-11
1、实验部分
1.1仪器和试剂
SpectraMax M5型多功能酶标仪(美国Molecular Devices公司);MB100-4A型微孔板恒温震荡器(杭州奥盛仪器有限公司);ZHLY-180型立式恒温振荡培养箱(上海知楚仪器有限公司);Sigma 3K15型台式高速冷冻离心机(德国希格玛公司);ProFlex型PCR仪(美国赛默飞公司);DV-ⅢULTRA型粘度计(美国Brookfield公司);旋转滴法界面张力仪(芬兰Kibron公司);EZ-Pi Plus便携式动态表面张力仪(芬兰Kibron公司)。
瓜尔胶为工业级,由长庆钰宸公司提供;葡萄糖、NaCl、KH2PO4、Na2HPO4、MgSO4、NH4NO3、CuSO4、Na2MoO4·2H2O、FeSO4·7H2O、KCl、CaCl2、MnCl2·4H2O、D-甘露糖和3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)均为分析纯试剂;胰蛋白胨、大豆蛋白胨、酵母粉、蛋白胨、植物凝胶和琼脂均为生物试剂;细菌基因组DNA抽提试剂盒购买于德国凯杰QIAGEN公司;细菌16S rRNA基因通用引物8F(5'-AGAGTTTGATCCTGGCTCAG-3')和805R(5'-GACTACCAGGGTATCTAATC-3')由南京金斯瑞生物科技股份有限公司合成。
1.2实验方法
1.2.1样品来源与培养基
本实验所用的水样是由长庆油田提供的压裂液返排水,土样采自云南省楚雄市魔芋生产田地。
富集培养基:胰蛋白胨15.0 g/L、大豆蛋白胨5.0 g/L、酵母粉2.5 g/L、葡萄糖2.5 g/L、NaCl 5.0 g/L、KH2PO4 2.5 g/L;固体初筛培养基:瓜尔胶10.0 g/L、KH2PO4 2.5 g/L、Na2HPO4 4.0 g/L、MgSO4 0.2 g/L、植物凝胶15.0 g/L、NH4NO3 1.0 g/L;复筛培养基:瓜尔胶10.0 g/L、NH4NO3 1.0 g/L、KH2PO4 2.5 g/L、Na2HPO4 4.0 g/L、MgSO4 0.2 g/L、酵母粉0.5 g/L、微量元素1.0%(体积分数);发酵产酶培养基:瓜尔胶15.0 g/L、NH4NO3 1.0 g/L、KH2PO4 2.5 g/L、Na2HPO4 4.0 g/L、MgSO4 0.2 g/L、酵母粉0.5 g/L、微量元素1.0%(体积分数);微量元素配方:CuSO4 0.1 g/L、Na2MoO4·2H2O 0.1 g/L、FeSO4·7H2O 2.0 g/L、CaCl2 1.0 g/L、MnCl2·4H2O 0.5 g/L;种子培养基:蛋白胨10.0 g/L、酵母粉5.0 g/L、NaCl 10.0 g/L;LB固体培养基:蛋白胨10.0 g/L、酵母粉5.0 g/L、NaCl 10.0 g/L、琼脂18.0 g/L。以上培养基在使用前,均在121℃高压灭菌20 min。
1.2.2菌株的高通量筛选
称取1.0 g魔芋地土样于锥形瓶中(魔芋地的土壤环境适合β-甘露聚糖酶产生菌的生长),加入5.0 mL水样和100.0 mL蒸馏水,在37℃、180 r/min的立式恒温振荡培养箱(摇床)中震荡培养30 min,充分混匀后室温静置1 h,分层后取2.0 mL上层清液转接于200.0 mL富集培养基中培养,37℃、180 r/min恒温震荡48 h。取200.0μL富集培养的菌液均匀涂布于以瓜尔胶为唯一碳源的OD 90 mm(培养基直径为90 mm)固体初筛培养基上,倒置培养60 h,之后用1.0%(质量分数)刚果红染液染色,观察菌落周围有无透明圈,挑取透明圈大的单菌落转接到于装有2.0 mL复筛培养基的96孔培养板中继续培养,在微孔板恒温震荡器中37℃、500 r/min震荡培养48 h。将培养后的发酵液置于台式高速冷冻离心机(离心机)中,4℃、3000 r/min离心20 min,上清液即为粗酶液,根据瓜尔胶降解情况及酶活力大小进行复筛,同时进行甘油保藏(甘油和LB溶液的体积比为1∶1)。
1.2.3菌株的形态观察及种属鉴定
形态特征观察将筛选得到的菌株接种于种子培养基中,37℃、180 r/min活化培养,取对数生长期菌液稀释涂布于LB固体培养基上,37℃倒置培养,观察菌落的形态特征。采用革兰氏染色法,在显微镜下观察菌体结构,并通过扫描电子显微镜观察菌体形态及大小。
分子生物学鉴定按照细菌基因组DNA抽提试剂盒说明书进行DNA的提取,以基因组DNA为模版,采用细菌的通用引物8F和805R进行PCR(聚合酶链式反应)扩增。对PCR产物进行琼脂糖凝胶电泳检测后,送至上海华大基因科技有限公司测序。将测序结果在NCBI数据库中(http://www.ncbi.nlm.gov/blast/)进行BLAST同源性比对(BLAST是在NCBI数据库中进行相似性分析的工具),并利用MEGA软件的N-J法构建系统发育进化树。
1.2.4酶活力的测定
采用3,5-二硝基水杨酸法对β-甘露聚糖酶酶活力进行测定,用pH=7.0的PBS缓冲液(每100 mL PBS缓冲液由38 mL 0.2 mol/L的Na2HPO4和62 mL 0.2 mol/L的KH2PO4配成)配制0.5%(质量分数)的瓜尔胶底物溶液。反应体系包含50.0μL粗酶液和450.0μL的瓜尔胶底物溶液,50℃反应10 min后,加入1.0 mL的DNS试剂终止反应,沸水浴10 min显色后,立刻冰水浴冷却至室温。取200.0µL反应液转移至96孔板中,在540 nm处用多功能酶标仪测定吸光度,实验每组设置3个平行,结果取平均值。以不同浓度D-甘露糖为标准品制作标准曲线,并根据标准曲线计算产生的还原糖量。在一定温度和pH值条件下,1 min催化底物水解产生1.0μmol相当于D-甘露糖的还原糖所需要的酶量,定义为1.0个酶活力单位。采用Bradford法测定蛋白质浓度,比活的定义为:每毫克酶蛋白所具有的酶活力。
1.2.5酶学性质表征
粗酶液的制备在无菌环境下将筛选得到的菌株接种到种子培养基中,37℃、180 r/min活化培养24 h,按5.0%的接种量转接到发酵产酶培养基中,37℃、180 r/min摇床培养72 h,将发酵液于4℃下,9000 r/min离心20 min,收集上清液,上清液即为粗酶液,于4℃冰箱冷藏备用。
最适温度按照1.2.4小节的方法分别在不同温度:5、10、15、20、25、30、35、40、50、60、70、80、90和100℃下反应,测定β-甘露聚糖酶活力。以未经处理的同温度下的瓜尔胶底物溶液作为空白对照。以最适温度下的酶活力为100%,计算不同温度下的相对酶活力。实验每组设置3个平行样,结果取平均值(下同)。
最适pH值分别用pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0的缓冲液配制0.5%(质量分数)瓜尔胶底物溶液,按照1.2.4小节的方法在最适温度下测定β-甘露聚糖酶活力。以未经处理的相同pH值的瓜尔胶底物溶液作为空白对照。以最适pH值下的酶活力为100%,计算不同pH值下的相对酶活力。
热稳定性将粗酶液分别在60、70和80℃的恒温水浴中孵育1 h,孵育期间每隔10 min取50.0µL该粗酶液加入瓜尔胶底物溶液中,按照1.2.4小节的方法在最适反应条件下测定β-甘露聚糖酶的残余活力,以评价酶的热稳定性。
pH值稳定性将粗酶液分别在pH值为4.0、5.0、6.0、7.0、8.0和9.0的缓冲液中孵育2 h,孵育期间每隔20 min取50.0µL该粗酶液加入瓜尔胶底物溶液混匀。按照1.2.4小节的方法在最适条件下测定β-甘露聚糖酶的残余活力,以评价酶的pH值稳定性。
1.2.6低温降解瓜尔胶
配制0.8%(质量分数)的瓜尔胶底物溶液,加入1.0%(体积分数)的粗酶液,分别在5和20℃下恒温水浴,测定不同作用时间下瓜尔胶溶液的粘度变化,每次测量3次取平均值。以未经处理的瓜尔胶溶液作为空白对照,评价反应温度为5和20℃时,β-甘露聚糖酶对瓜尔胶的降粘效果。降粘率(Viscosity Reduction Rate,VRR)的计算如公式(1)所示:
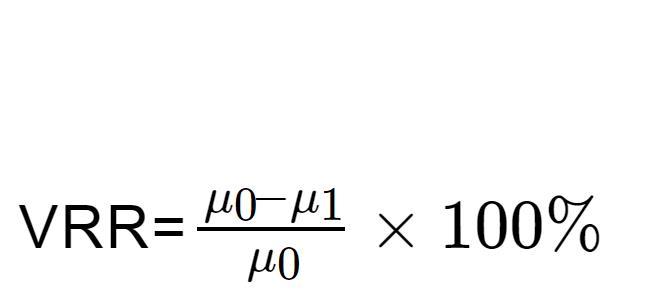
式中,μ0为降粘前的粘度(mPa∙s),μ1为降粘后粘度(mPa∙s)。
1.2.7破胶性能评价
压裂液的配制按照国标SY/T 5107-2016《水基压裂液性能评价方法》中压裂液试样制备方法制备压裂液。压裂液配方为:基液:0.35%(质量分数)瓜尔胶、1.0%(质量分数)KCl、0.1%(质量分数)杀菌剂、0.18%(质量分数)Na2CO3、0.036%(质量分数)NaHCO3;交联液:1.0%(体积分数)硼砂溶液,交联剂比为100∶5(体积比);酶破胶剂:1.0%(体积分数)。
粘度的测定按配方配制压裂液,将加入酶破胶剂的冻胶分别置于5、10、15、20、25、30、40、50、60、70、80和90℃的恒温水浴中,在破胶3和6 h时取其上层清液,于室温下用粘度计测定破胶液的粘度,每次测量3次取平均值(下同)。
表面张力和界面张力的测定待压裂液交联后,加入酶破胶剂,分别在10、20和50℃的恒温水浴中破胶3 h,待破胶液的粘度降低到5 mPa·s以下后,将破胶液倒入烧杯中,用表面张力仪测定破胶液的表面张力,用界面张力仪测定破胶液与煤油界面张力,测试温度为50℃。
残渣量的测定按照国标SY/T 5107-2016《水基压裂液性能评价方法》中指出的残渣量的检测方法进行测定。制备定量体积V0的压裂液冻胶,加入酶破胶剂,分别置于10、20和50℃的恒温水浴中破胶。室温测定破胶液粘度低于5 mPa·s时视为彻底破胶。将彻底破胶后的溶液全部转移到已经烘干称重的离心管中(质量记为m0),在离心机中5000 r/min离心30 min,慢慢倒出上层清液,然后用蒸馏水清洗破胶容器后倒入离心管中,再次离心20 min并倒出上层清液。将离心管放入干燥箱中105℃下烘干至恒重(质量记为m1)。压裂液残渣含量计算如公式(2)所示:
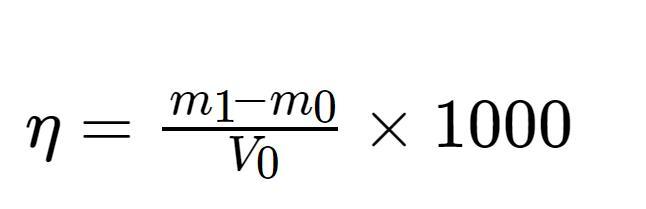
式中,η为压裂液残渣质量浓度(mg/L);(m1-m0)为残渣质量(mg);V0为压裂液用量(mL)。
产低温β-甘露聚糖酶的菌株O5提升低温油藏压裂液的破胶性能——摘要










