合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
-
> 表面张力能怎么玩?下面就是一些常见的小实验方案~
> 超微量天平应用于EPM2000玻璃纤维滤膜的快速消解
> 橘皮素与环糊精在油水界面自组装行为对脂质消化的影响
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(一)
> 化学驱:油藏防窜剂用量和浓度多少为好?
> 硅丙乳液质量分数与粘度、表面张力的关系及在模拟病害壁画修复中的应用(二)
> DEAE-琼脂糖LB膜的制备方法、最佳成膜浓度及表面电势测定
> 衣康酸型反应性表面活性剂在新型皮革化学品中的应用研究进展
> 筛板萃取塔中液滴行为的影响因素,筛板对界面张力体系液滴有何作用
> 沥青质及其亚组分与烷基苯磺酸钠水溶液在降低IFT中的协同机理(二)
推荐新闻Info
-
> 助剂对乙基多杀菌素药液在杧果叶片润湿铺展行为、表面张力的影响——讨论
> 助剂对乙基多杀菌素药液在杧果叶片润湿铺展行为、表面张力的影响——结果与分析
> 助剂对乙基多杀菌素药液在杧果叶片润湿铺展行为、表面张力的影响——摘要、材料与方法
> 阳-非离子复合表面活性剂体系表面张力测定及基础性能评价(三)
> 阳-非离子复合表面活性剂体系表面张力测定及基础性能评价(二)
> 阳-非离子复合表面活性剂体系表面张力测定及基础性能评价(一)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(三)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(二)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(一)
> 界面流变仪可以测量液体表面张力吗?界面流变仪与界面张力仪区别解析
混合型生物洗油菌发酵上清液的表面张力值测定(二)
来源:东北石油大学三亚海洋油气研究院 黑龙江省科学院微生物研究所 浏览 543 次 发布时间:2025-01-03
本实施方式中的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)ZZ-11于2023年9月,从哈尔滨市的农作物根际土壤中分离纯化获得。
①分离方法采用梯度稀释法:去除表土,取5~20cm深处的土样几十克石油污染土壤,盛入事先灭过菌的防水纸袋内;取10g石油污染土壤在90mL无菌水三角瓶中振摇(摇床振摇30min静置),然后取5mL上清液接种于95mL无菌的牛肉膏液体培养基中,在温度为30℃、摇床转速为150r/min的恒温摇床培养2d;之后取土样液逐级稀释至10-6。挑取单菌落接种LB培养基平板中涂匀于28℃恒温培养。
②纯化方法:反复划线培养,直至确认同一平板中菌落的形态和大小都相同,得到纯化后的单菌株ZZ-11。
③革兰氏染色:挑取单菌落进行革兰氏染色并镜检,鉴别细菌的类型。
④16s测序鉴定,该菌株16S rDNA的核苷酸序列如SEQ ID NO:1所示。
该菌株16S rDNA序列比对(NCBI数据库)与芽孢杆菌属(Bacillus)的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)有极高的同源性,同源性为98%以上,并结合该菌株的革兰氏染色(如图1所示)和镜检结果认定其为解淀粉芽孢杆菌,命名为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)ZZ-11。
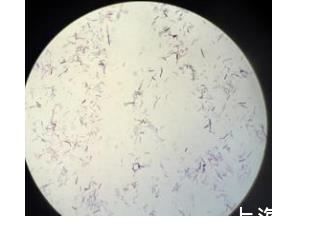
图1是解淀粉芽孢杆菌(Bacillus amyloliquefaciens)ZZ-11革兰氏染色观察图;
本实施方式解淀粉芽孢杆菌(Bacillus amyloliquefaciens
)ZZ-11可采用LB培养基培养,培养温度为28~30℃。本实施方式解淀粉芽孢杆菌(Bacillus amyloliquefaciens)ZZ-11在LB固体培养基上菌落形态为污白色圆形或不规则菌落,表面粗糙,粘稠(如图2所示),经革兰氏染色为革兰氏阳性菌。
图2是解淀粉芽孢杆菌(Bacillus amyloliquefaciens)ZZ-11平板培养菌落观察图;
具体实施方式二:本实施方式一种可用于洗油的微生物,其为胶冻样芽孢杆菌(Bacillus mucilaginosus)ZZ-8,保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC N0.30789。
本实施方式中的胶冻样芽孢杆菌(Bacillus mucilaginosus)ZZ-8于2023年9月,从哈尔滨市的农作物根际土壤中分离纯化获得。
分离方法采用梯度稀释法:去除表土,取5~20cm深处的土样几十克石油污染土壤,盛入事先灭过菌的防水纸袋内;取10g石油污染土壤在90mL无菌水三角瓶中振摇(摇床振摇30min静置),然后取5mL上清液接种于95mL无菌的牛肉膏液体培养基中,在温度为30℃、摇床转速为150r/min的恒温摇床培养2d;之后取土样液逐级稀释至10-6。挑取单菌落接种LB培养基平板中涂匀于28℃恒温培养。
②纯化方法:反复划线培养,直至确认同一平板中菌落的形态和大小都相同,得到纯化后的单菌株ZZ-8。
③革兰氏染色:挑取单菌落进行革兰氏染色并镜检,鉴别细菌的类型。
④16s测序鉴定,该菌株16S rDNA的核苷酸序列如SEQ ID NO:2所示。
该菌株16S rDNA序列比对(NCBI数据库)与芽孢杆菌属(Bacillus)的胶冻样芽孢杆菌(Bacillus mucilaginosus
)有极高的同源性,同源性为98%以上,并结合该菌株的革兰氏染色(如图3所示)和镜检结果认定其为胶冻样芽孢杆菌,命名为胶冻样芽孢杆菌(Bacillus mucilaginosus)ZZ-8。
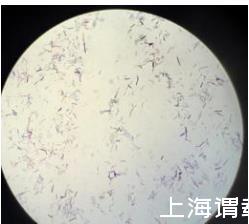
图3是胶冻样芽孢杆菌(Bacillus mucilaginosus)ZZ-8革兰氏染色观察图;
本实施方式胶冻样芽孢杆菌(Bacillus mucilaginosus)ZZ-8可采用LB培养基培养,培养温度为28~30℃。本实施方式胶冻样芽孢杆菌(Bacillus mucilaginosus
)ZZ-8在LB固体培养基上菌落形态为无色透明,有光泽,表面光滑,圆形隆起,粘稠、边缘整齐(如图4所示),经革兰氏染色为革兰氏阴性菌。
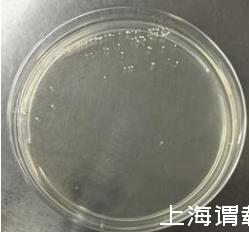
图4是胶冻样芽孢杆菌(Bacillus mucilaginosus)ZZ-8平板培养菌落观察图;
具体实施方式三:本实施方式用于微生物洗油的混合菌剂由解淀粉芽孢杆菌(Bacillus amyloliquefaciens)ZZ-11和胶冻样芽孢杆菌(Bacillus mucilaginosus)ZZ-8组成。
具体实施方式四:本实施方式与具体实施方式三的不同点在于:混合菌剂中解淀粉芽孢杆菌(Bacillus amyloliquefaciens)ZZ-11与胶冻样芽孢杆菌(Bacillusmucilaginosus)ZZ-8的数量比为(108~109):(107~108)。其它与具体实施方式三相同。
具体实施方式五:本实施方式与具体实施方式三或四的不同点在于:混合菌剂中菌落总浓度为108~109cfu/mL。其它与具体实施方式三或四相同。
实施例1
乳化性能测试:
将解淀粉芽孢杆菌(Bacillus amyloliquefaciens)ZZ-11、胶冻样芽孢杆菌(Bacillus mucilaginosus)ZZ-8、混合菌剂(解淀粉芽孢杆菌(Bacillusamyloliquefaciens
)ZZ-11和胶冻样芽孢杆菌(Bacillus mucilaginosus)ZZ-8按1:1数量比混合)分别接种于LB液体培养基中,在28~30℃条件下振荡培养发酵,直至发酵液中菌落浓度达到108
~109cfu/mL。
在25ml具塞量筒中分别加入上述5ml发酵液和5ml原油,随后置于45℃恒温箱内20min。密闭后将具塞量筒剧烈振荡5min,然后再次置于45℃恒温箱中静置,同时开始计时,每隔10min记录试管中分离出水的体积,计算析水率。重复实验三次。其公式为Ed=Vw/V,式中,Ed为析水率;Vw为析水量,mL;V为总体水相体积,mL。
利用析水率评价生物表面活性剂作用原油后形成水包油型乳状液的稳定性,析水率数值越小,说明乳状液越稳定,体系的乳化性能越强。从图中可以看出随着时间的延长各组析水率不断增加,一段时间后ZZ-11、ZZ-8、混合菌剂的析水率稳定,分别为47%、44%和16%(如图5所示)。
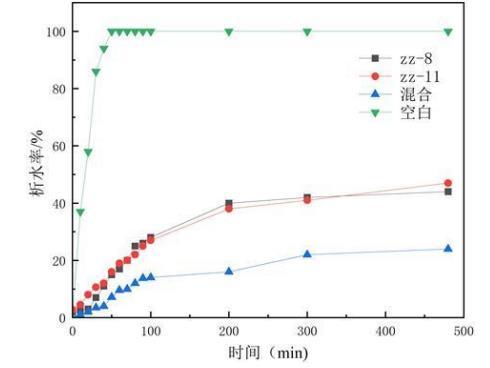
图5是实施例1乳化性能测试中ZZ-11、ZZ-8、混合菌剂析水率曲线图。
析水率可用于评价生物表面活性剂对原油的乳化性能,根据实验结果可知解淀粉芽孢杆菌(Bacillus amyloliquefaciens)ZZ-11和胶冻样芽孢杆菌(Bacillusmucilaginosus)ZZ-8发酵液均具有良好的乳化性能,混合菌剂的乳化性能更为优异和突出。










