合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
-
> 不同浓度下甘草酸溶液界面张力的变化
> 触感点阵文字盲人印刷时,如何控制UV油墨表面张力流平时间
> 山茶油改性方法、制备原理及在水剂型化妆品中的应用(二)
> 多频超声波技术&人工神经网络构建变压器油界面张力预测模型(一)
> pH对马来松香MPA与纳米Al2O3颗粒形成的Pickering乳液类型、表/界面张力影响(四)
> NaOL、HZ组合捕收剂对锂辉石矿物浮选效果、表面张力影响(一)
> 新设计的拼接式固相萃取柱完美解决萃取柱出现空气栓塞问题
> 乳化剂、皂液pH值、缔合型增稠剂T对乳化沥青油水界面张力和贮存稳定性的影响
> 基于界面张力和表面张力测试评估商用UV油墨对不同承印纸张的表面浸润性差异(三)
> 电子产品的制造过程中对表面张力的要求
推荐新闻Info
-
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(三)
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(二)
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(一)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(四)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(三)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(二)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(一)
> 表面张力实验、接触角实验分析抑尘试剂对煤的润湿结果
> Kibron表面张力仪研究烧结矿聚结行为
> 基于界面张力和表面张力测试评估商用UV油墨对不同承印纸张的表面浸润性差异(三)
诱导期测定法研究NaCl的添加对碳酸锂固-液界面张力等成核动力学参数影响——结果与讨论
来源:高等学校化学学报 浏览 473 次 发布时间:2025-02-14
3结果与讨论
3.1温度和过饱和度对Li2CO3成核诱导期的影响
温度和过饱和度是影响晶体成核诱导期的两个重要因素,分别在288.15,298.15和323.15 K时测定了不同过饱和度下Li2CO3的成核诱导期,结果如图1所示.可知,在同一过饱和度下,Li2CO3的成核诱导期随温度的升高而缩短;在同一温度下,Li2CO3的成核诱导期随过饱和度的增大而缩短,并且这种趋势在低温(288.15 K)下更为明显.
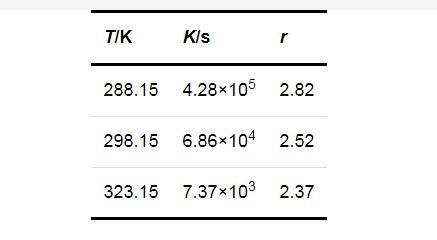
Liu和Nancollas[32]提出了一个反映成核诱导期(tind)与温度关系的经验方程式:
tind=τexp(Eact/RT)(7)
式中:Eact(J/mol)为成核反应的活化能,表示从反应物到生成物需要克服的能垒高度;τ为常数.
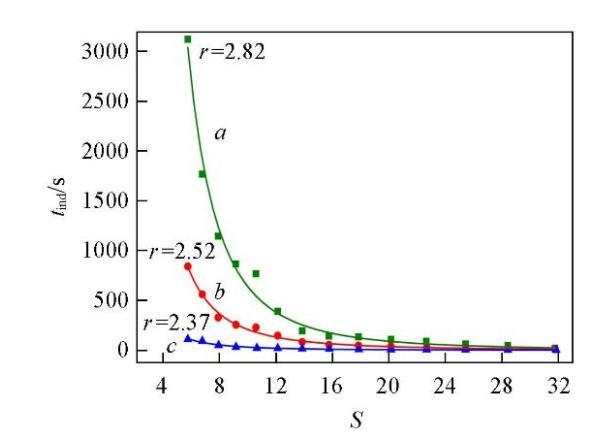
图2显示了3个不同的过饱和度下lntind与1/T的关系.可见,lntind与1/T之间呈线性关系,由直线的斜率可以计算得到Li2CO3的成核活化能Eact为63.69 kJ/mol.
成核诱导期与过饱和度的半经验关系式[33]如下:

tind=K/Sr(8)
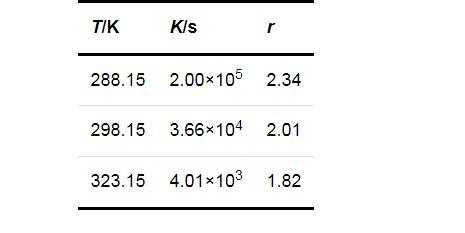
式中:K和r均为方程参数,可由实验数据回归得出.将图1的数据回归结果列于表1.进一步说明了过饱和度对成核诱导期的影响在较低的温度下更为显著.
3.2固-液界面张力的计算
为了更深入地研究Li2CO3的成核过程,将以Li2CO3晶核与周围溶液间的固-液界面张力为切入点来探讨其成核机制.
晶核与周围溶液间的固-液界面张力γS(J/m2)是计算和模拟晶体成核以及晶体生长速率的基本参数[34].根据经典初级成核理论[16],成核速率J[个/(cm3·s)]可表示为
J=Aexp[−βγ3SV2mNAf(θ)(RT)3(ln S)2](9)
式中:A为频率常数,代表单位时间内粒子碰撞晶体表面的次数;β为晶体的形状因子(对于球形颗粒,其数值为16π/3);Vm为晶体的摩尔体积(对于Li2CO3晶体,其值为35.01 cm3/mol[35]);NA为阿伏伽德罗常数;f(θ)为修正因子[36],晶体的成核过程为均相成核时f(θ)=1,晶体的成核过程为非均相成核时f(θ)<1.
对于初级均相成核,成核速率与诱导期tind成反比,因此,式(9)可改为如下形式:
lgtind=B(lgS)2+C(10)
式中:C为方程常数;B=βγ3SV2mNAf(θ)/(2.3RT)3
.所以,固-液界面张力γS可由下式计算:
γS=2.3RT(BβV2mNAf(θ))1/3(11)
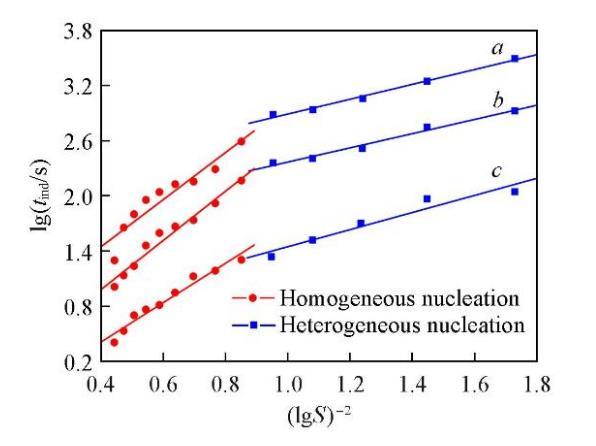
诱导期与初始过饱和度之间存在着很强的依赖关系.当初始过饱和度足够高时,成核可认为是均相的;当初始过饱和度足够低时,成核则以非均相为主[37].在恒定温度下,由晶体成核过程中的lgtind对(lgS)‒2作图可得两条斜率不同的直线,分别对应着两种不同的成核机制,即初级均相成核和初级非均相成核[37].由不同温度时Li2CO3的lgtind对(lgS)‒2作图,结果如图3所示.可知,成核机制的变化引起了直线斜率的改变,均相成核对应的直线斜率明显大于非均相成核时的直线斜率(Bhom>Bhet).在较低的过饱和度时,成核以非均相成核为主;而过饱和度增大到12.13以后,成核则以均相成核为主.
根据均相成核和非均相成核理论,在非均相成核条件下形成临界晶核所需自由能的变化(ΔGhet)与均相成核条件下形成临界晶核所需自由能的变化(ΔGhom)间的关系为

ΔGhet=φΔGhom(12)
式中:φ为形状因子(0<φ<1),表示溶液体系中外来微粒的表面分子对溶质分子有序化的影响,计算如下:
φ=BhetBhom(13)
假设晶核形状为球形,则
φ=2−3cosθ+(cosθ)34(14)
式中:θ为晶核与外来固态杂质之间的接触角(0°≤θ≤180°),反映晶核与外来杂质之间的亲和程度,从而决定外来杂质对初级成核的影响.
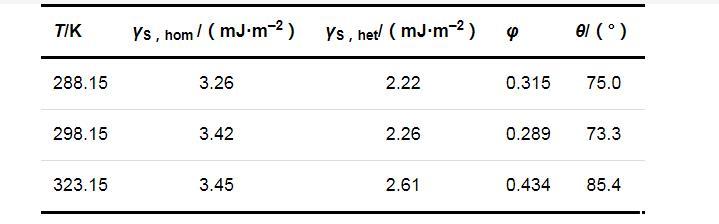
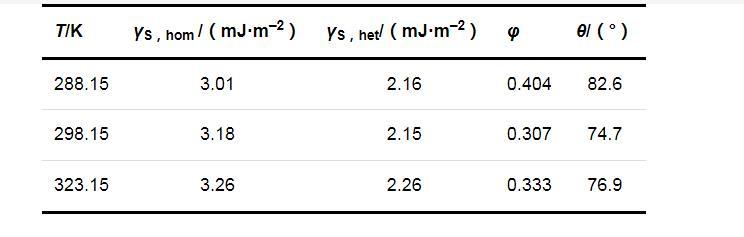
两种成核机制时的固-液界面张力(γS,hom和γS,het)、形状因子(φ)和接触角(θ)的计算结果列于表2.可以看出,在同一温度下,均相成核时的固-液界面张力大于非均相成核时的固-液界面张力;温度对固-液界面张力的影响并不明显,固-液界面张力只随温度的升高略有增加.
3.3 NaCl的添加对Li2CO3成核的影响
分别在288.15,298.15和323.15 K时研究了NaCl的添加对Li2CO3成核诱导期的影响,每组实验均在Cl‒的超额含量(Y=0.5)的条件下进行,结果见图4.可知,在同一温度下,Li2CO3的成核诱导期仍然随过饱和度的增大而缩短;在同一过饱和度下,Li2CO3的成核诱导期随温度的升高而缩短,而且在添加NaCl(Y=0.5)后,温度对Li2CO3成核诱导期的影响比未添加(Y=0)时更为显著.如,在过饱和度S=5.76,温度从288.15 K升高到323.15 K时,添加NaCl后Li2CO3的成核诱导期缩短了73.01%,而未添加NaCl时Li2CO3的成核诱导期缩短了67.89%.
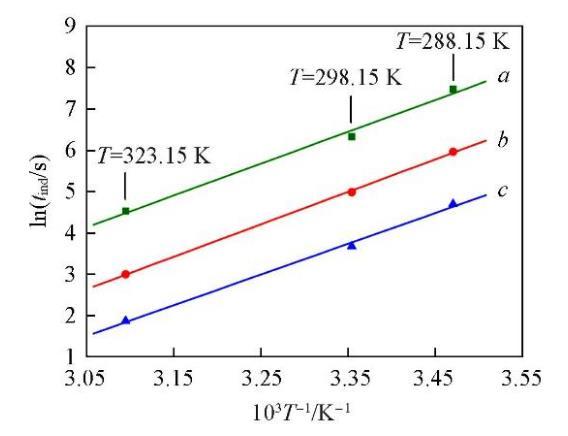
将图1与图4对比可知,添加NaCl后Li2CO3的成核诱导期明显增长,说明体系中过量Cl‒的存在抑制了Li2CO3的成核.用图4中的实验数据回归了式(8)中的参数数值,结果列于表3.由回归的参数数值可知,过饱和度对诱导期的影响仍然是在较低的温度下更为显著.
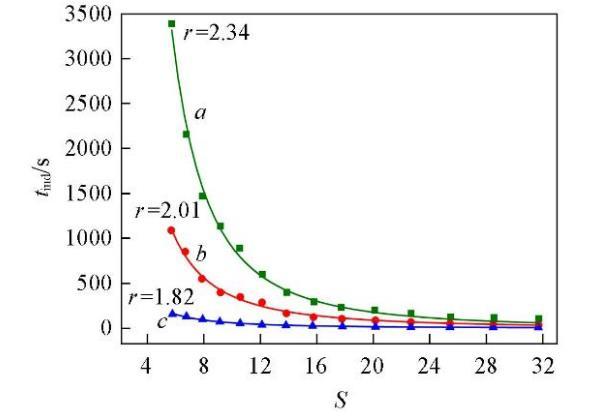
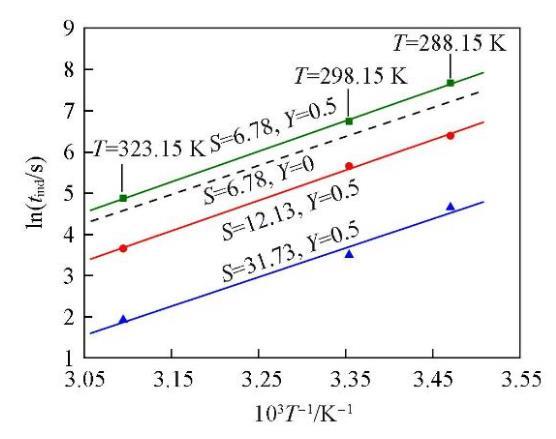
图5为添加NaCl后,在3个不同的过饱和度(Y=0.5;S=6.78,12.13,31.73)下lntind与1/T的关系图.并将未添加NaCl,过饱和度S=6.78时lntind与1/T的关系曲线作为对比,以虚线表示.可以看出,这条虚线的斜率比图中3条平行直线的斜率小,表明添加NaCl后,温度对Li2CO3成核诱导期的影响更为显著.由图5中3条平行直线的斜率计算可得,添加NaCl后(Y=0.5)Li2CO3成核反应的活化能为72.85 kJ/mol,明显高于未添加NaCl时(Y=0)的活化能63.69 kJ/mol.进一步说明添加NaCl后,体系中过量Cl‒的存在对Li2CO3的成核过程产生了抑制作用.
由图6可以看出,两种成核机制的分界点大约在S=12.13处,过饱和度小于此数值时成核以非均相成核为主,大于此数值后成核以均相成核为主.添加NaCl后,两种成核机制的固-液界面张力(γS,hom和γS,het)、形状因子(φ)和接触角(θ)的计算结果列于表4.可以看出,在同一温度下,均相成核时的固-液界面张力大于非均相成核时的固-液界面张力;温度的改变对固-液界面张力的影响仍不明显.通过对比表2与表4的数据可知,添加NaCl后Li2CO3晶核与周围溶液的固-液界面张力与未添加NaCl时的数值相比略有减小,所以在Li2CO3成核过程中,NaCl的添加对晶核与周围溶液的固-液界面张力的影响可以忽略.
4结论
在288.15~323.15 K的温度范围内,使用激光在线装置测量了Li2CO3在过饱和度(S)为5.76~31.73范围内的成核诱导期.其中,Li2CO3在溶液中的过饱和度采用OLI电解质与水化学物性分析软件内嵌的全组分模型严格计算.通过研究温度、过饱和度以及NaCl的添加(Y=0.5)对Li2CO3在LiCl-Na2CO3溶液体系中成核诱导期的影响,发现在同一过饱和度下,Li2CO3的成核诱导期随温度的升高而缩短;在同一温度下,过饱和度的增大加快了Li2CO3的成核.添加NaCl后Li2CO3的成核诱导期明显增长,说明体系中过量Cl‒的存在抑制了Li2CO3的成核,并且这种抑制现象在较低的温度下更为显著.通过计算可知,添加NaCl后Li2CO3成核反应的活化能(Y=0.5,72.85 kJ/mol)明显高于未添加NaCl时的活化能(Y=0,63.69 kJ/mol),进一步说明了NaCl对Li2CO3成核产生了抑制作用.最后通过所测得Li2CO3的成核诱导期和过饱和度的关系式计算了晶核和周围溶液间的固-液界面张力.结果表明,在同一温度下,均相成核时的固-液界面张力始终大于非均相成核时的固-液界面张力,温度的改变以及NaCl的添加对它们的影响均可忽略.研究结果为研究Li2CO3的结晶过程提供了重要的理论指导和数据支撑,也为盐湖提锂工艺的优化提供了借鉴.










