合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 界面张力作用下泥质钻渣泥化黏附机理分析
> 表面张力低至26 mN/m以下,可提高深层煤岩气解吸量
> 基于阴离子−非离子型表面活性剂复配最佳强化润湿高效驱油体系——结果与讨论、结论
> 基于阴离子−非离子型表面活性剂复配最佳强化润湿高效驱油体系——实验部分
> 基于阴离子−非离子型表面活性剂复配最佳强化润湿高效驱油体系——摘要
> 不同助剂及浓度对IDK120-025型和LU120-015型喷头雾化效果的影响(四)
> 不同助剂及浓度对IDK120-025型和LU120-015型喷头雾化效果的影响(三)
> 不同助剂及浓度对IDK120-025型和LU120-015型喷头雾化效果的影响(二)
> 不同助剂及浓度对IDK120-025型和LU120-015型喷头雾化效果的影响(一)
> 我第一次操作表面张力仪的心得体会
应用荧光显微镜研究了蛋白质在气-水界面的组装——结果和讨论
来源:上海谓载 浏览 1794 次 发布时间:2021-12-14
3.结果和讨论
通过CD光谱(圆二色光谱和支持信息中的图S3)和表面压力测量(图S4)对HSA-TR和野生型HSA进行比较表明,染料标记仅轻微干扰HSA的二级结构和疏水性。通过Langmuir-Schaefer技术和AFM,我们证明了在AWI处形成的蛋白质膜可转移到云母表面,并且类似于一层蛋白质层厚(∼3 nm)用于HSA-TR和HSA(图S5)。这与先前的中子反射率研究(建议为单层)非常一致。16因此,最小标记、接近天然的HSA为通过荧光显微镜研究AWI组装提供了有用的模型蛋白质样品。
在图1中,HSA-TR溶解在PBS中(离子强度=193 mM),并在前面所述的小室装置中成像(图1A)。当HSA-TR([HSATR])的浓度大于或等于0.050 mg/mL时,通过共聚焦显微镜观察到均匀的荧光层,如图1B所示。光学分辨率为∼0.2μm,4倍变焦图像(图1C)显示界面层没有特殊结构。然而,当[HSA-TR]小于或等于0.025 mg/mL时,在界面处观察到高度不均匀结构,如图1D所示。放大图像(图1E)显示HSA-TR组装成微米大小的分形结构。XZ平面图像进一步证实了不同的结构,图1F中观察到厚度均匀的荧光层,而图1G中观察到不连续的荧光层。我们的结果表明,在PBS中离子强度为193mm的条件下,表面饱和体积溶液浓度(CB sat)在0.025和0.050 mg/mL之间。在CB sat以下,吸附的蛋白质不能完全覆盖AWI,因此允许在界面处形成蛋白质结构域。以前使用张力测定法和椭偏法的报告发现,覆盖AWI的BSA临界浓度在10-2和10-1 mg/mL之间,13这与我们的结果非常吻合。
尽管蛋白质吸附领域的研究人员普遍接受CB sat的概念,13,34但很少有研究揭示了浓度低于WCB sat的组装蛋白质的微观结构。Powers等人报告了在AWI上观察到由两亲性肽形成的相结构域。23 Lee等人最近利用微流变学进行的一项研究表明,在相对较低的浓度下,AWI的β-乳球蛋白层中存在机械不均一性。在我们之前的研究中,在用俄勒冈州绿标记的人纤维蛋白原的AWI处也观察到不连续的荧光层,如果蛋白质在类似的缓冲条件下以0.01 mg/mL溶解。30早期基于2D晶格的模拟预测,在低浓度下,可通过扩散限制聚集形成分形网络。36 AWI处的XY平面图像(图1E)证实了在低亚相浓度下AWI处存在分形组装和AWI处的异质蛋白质层。
然后,我们改变溶液的离子强度和氧化还原状态,并监测AWI形成的蛋白质组装体。在将溶液移液到腔室后,在成像之前将界面老化1小时。PBS中0.010 mg/mL HSA-TR(离子强度=53 mM)的样品在界面不同位置显示出分形组装(图2A)和相互连接的“瑞士干酪”结构(图2B)。XY平面图像的Z叠层显示了相同条件下界面蛋白质层的高分辨率3D图像(图2C)。3D图像是尺寸为45.0*45.0μm2的多个XY平面图像的叠加,这些图像沿AWI上方和下方的Z轴采集,每个方向10μm(200*0.1μm步长)。这证实了界面处的“瑞士奶酪”结构,并且几乎没有显示来自亚相的荧光信号。虽然沿Z轴的光学分辨率是∼2μm对于共焦图像,其比估计的蛋白质层厚度(30-40Å)大得多,Z-stack图像清楚地表明蛋白质结构域仅在AWI处形成,并且与在XY平面形成的结构域(数百微米)相比,Z方向上的组装受到限制。
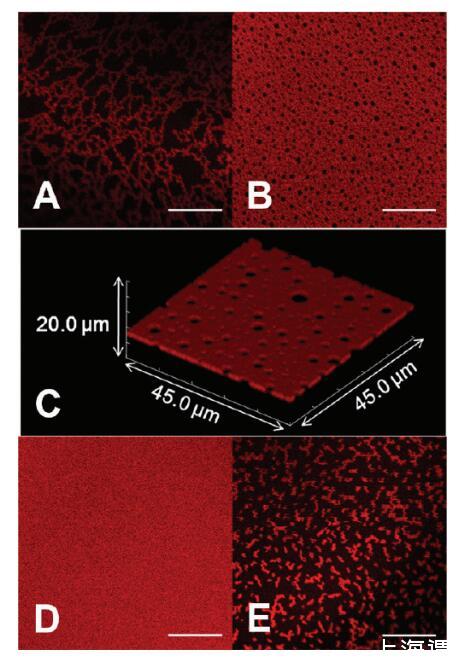
图2。蛋白质组装的形态,随离子强度和还原剂的添加而变化。HSATR(0.01 mg/mL)在(A,B)PBS中的AWI下自组装,pH值7.2,离子强度=53 mM和(C)在扫描体积为45.0*45.0*20.0μm3的情况下,呈现了与图像B相同的溶液条件对应的共焦图像Z叠层。(D)PBS,pH值7.2,离子强度=530 mM。(E)30 mM DTT,pH 7.2,离子强度=53 mM的PBS。比例尺:20μm。
在保持蛋白质浓度不变的情况下,我们将缓冲液的离子强度增加到530mm。老化1小时后,我们观察到均匀荧光层(图2D),表明表面过剩增加,平衡时间缩短。在缓冲液中含有30mmDTT(图2E)的样品中,观察到小的分形结构,表明吸附蛋白质之间的相互作用较弱。我们还研究了HSA-TR在高离子强度(530mm)的PBS中溶解时界面层形成的动力学。观察到从密集分形(图3A)到瑞士奶酪结构(图3B)以及最终到均匀荧光层(图3C)的明显转变。在大约30分钟内,AWI达到平衡,形成均匀的荧光层。Dhar等人最近的一项研究发现,随着时间的推移,BSA层的表面粘度急剧增加,并推断出组织结构发生了变化。37我们的研究直接显示了从分形到均匀组织层的形态转变,这可以解释观察到的抗剪切性增加。

图3。显示异质结构域转变为同质层的荧光图像。C(HSA-TR)=PBS中的0.01 mg/mL,pH值7.2,离子强度=530 mM。(A)3、(B)8和(C)将蛋白质溶液引入试验箱后36分钟。标尺:50μm。
我们的结果表明,溶液条件可以调节蛋白质自组装的结构。HSA的等电点约为4.7。24因此,在pH值为7.2时,HSA-TR带负电。静电排斥强烈影响HSA-TR在AWI处的聚集,导致低包装效率,如图2A,B所示。分形结构和瑞士干酪结构共存表明非平衡状态,这是由于蛋白质从亚相的缓慢吸附受到界面上已经存在的带电蛋白质的排斥力的阻碍。在较高的离子强度下,带电蛋白质分子之间的静电斥力被更有效地屏蔽,HSA-TR吸附到界面的速度更快,并且能够更紧密地堆积,从而形成更均匀的层。如图2D和3C所示,AWI的完全覆盖率低于CB sat。在较低的离子强度(193 mM)下,在吸附时间1 h后,测定CB sat在0.025和0.050 mg/mL之间的值。在较高的离子强度(530mm)下,由于被吸附的蛋白质和来自块体的蛋白质之间的排斥作用较小,因此块体溶液蛋白质对AWI的吸附更快。此外,蛋白质分子在界面上的堆积效率更高,从而实现了更高的蛋白质覆盖率。
据报道,吸附在AWI上的蛋白质可以形成分子间二硫键,从而稳定蛋白质网络并增强吸附层的弹性。38 HSA有一个反应性半胱氨酸,Cys34,可在AWI处与相邻蛋白质形成二硫键。此外,吸附后构象的变化可能导致分子内二硫键的断裂,为分子间二硫键的形成提供更多的反应位点。DTT等还原剂抑制分子间二硫键的形成,因此只剩下小聚集体,这些聚集体可能通过疏水相互作用结合在一起。Vogler等人应用界面流变学来研究AWI处的HSA,并发现吸附层既具有粘性又具有弹性。28二硫键的形成支持弹性来自分子间相互作用网络的假设。有趣的是,利用BSA进行的微流变学研究发现,蛋白质膜主要是粘性的,没有形成强的分子间键。37因此,AWI处蛋白质二硫键的作用可能在不同的蛋白质系统中有很大差异。
最后,将FDA批准的表面活性剂F-127添加到HSA-TR溶液中,以改变AWI处吸附物种之间的疏水相互作用。疏水相互作用导致蛋白质中疏水单元的组装或聚集,从而降低溶剂化能。39在蛋白质组装中,多个蛋白质分子的疏水斑块倾向于聚集在一起,将水从其表面排除,从而增加系统的熵。40当添加更疏水的表面活性剂时,它与蛋白质-蛋白质疏水相互作用竞争。已知表面活性剂在AWI处与蛋白质相互作用,显着降低表面张力并改变表面层的流变行为。41如Morris等人先前AFM研究中的“造山”模型所述,表面活性剂以非均匀方式从AWI置换蛋白质。19然而,只有BAM研究18提供了现场测量的直接证据,动态转变的各个方面仍然未得到充分探索。
通过我们的原位荧光显微镜方法,我们在HSA-TR/F-127混合物的AWI处发现了荧光强度较强和较弱的区域,表明发生了相分离。蛋白质在AWI处形成粘弹性网络,导致蛋白质的分子迁移率比蛋白质-表面活性剂混合物的分子迁移率小2个数量级。41因此,我们预计富含蛋白质区域的荧光恢复速度应比表面活性区域慢得多。为了验证这一假设,我们进行了FRAP实验,用HSA-TR/F-127溶液(HSA-TR为0.10 mg/mL)和F-127溶液(HSA-TR为0.0050 mg/mL)评估界面层的流动性。用近紫外激光束同时漂白强荧光和弱荧光区域的两个圆形区域20 s。在之前和之后拍摄图像使用衰减的543nm激光作为激发源进行漂白。照射90秒后,左上方的漂白区变小,25分钟后,强度几乎完全恢复;然而,右下方的漂白区域并未随时间改变形状或强度(图4)。因此,我们得出结论,强度恢复率的巨大差异表明界面上“富含蛋白质”和“富含表面活性剂”区域的分离。荧光强度较强的区域主要由HSA-TR组成,荧光强度较弱的区域主要由HSA-TR与F-127混合组成。表面活性剂富集区的蛋白质被表面活性剂分子分离,更容易扩散,使得HSA-TR的横向迁移率远高于蛋白质富集区。然而,荧光恢复期间漂白区形状的变化表明,富含表面活性剂的区域中的质量传输不均匀。结合多种扩散过程的适当分析方法,FRAP实验有可能确定AWI处蛋白质分子扩散系数的分布。

图4。界面层光漂白后的荧光恢复。ROI(黄色圆圈)是选定的光漂白区域。ROI-1位于富含表面活性剂的区域,而ROI-2位于富含HSA TR的区域。初始亚相浓度为[HSA-TR]=0.10 mg/mL和[F-127]=0.0050 mg/mL。比例尺:20μm。
我们发现在HSA-TR/F-127混合物中,蛋白里奇区表现出随时间变化的形态变化,这促使我们更详细地研究这一动态现象。图5所示的结果是通过将HSA-TR(0.50 mg/mL)与F-127(0.015 mg/mL)混合,聚焦在AWI上拍摄的图像。图5A显示了将溶液用移液管移入腔室后35至60分钟内聚焦在同一区域的三幅图像。可见面积为10-100μm2的小圆形蛋白质岛。感兴趣区域(ROI,由图5中的黄色方框表示)突出显示了一些有趣的观察结果:在ROI-1中,与35分钟时的图像相比,小的蛋白质岛在50分钟时与周围的蛋白质岛结合形成一个更大的岛。在ROI-2中,从50分钟开始可以看到小黑洞,表明F-127在这些位点取代了HSA-TR,并在富含蛋白质的区域内形成空腔。在ROI-3中,可以观察到表面活性剂富集区前沿的移动。很明显,随着时间的推移,表面活性剂富集区不断扩大。在ROI-4中,小的蛋白质岛合并成网状网络。
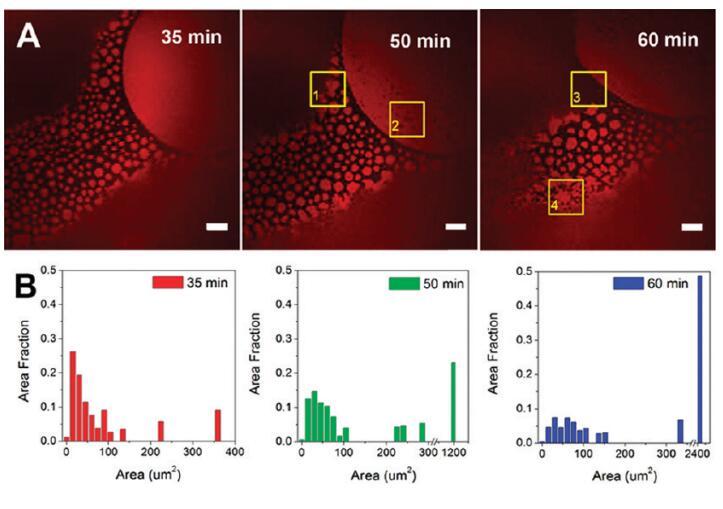
图5。蛋白质岛随时间的聚合。(A)导入后35、50和60分钟拍摄的共焦荧光图像。比例尺:20μm.(B)蛋白质岛大小分布的直方图。初始亚期浓度为[HSA-TR]=0.50 mg/mL和[F-127]=0.015 mg/mL。ROI-1表示一个区域(黄色框),其中小的蛋白质岛与周围的蛋白质岛结合形成一个较大的岛;ROI-2表明该区域形成了小黑洞;ROI-3表示在表面活性剂富集区域的边界处的运动;ROI-4显示了小的蛋白质岛合并成网状网络的地方。
我们使用ImageJ分析了蛋白质岛的大小分布(图5B)。31面积分数定义为相同大小的蛋白质岛的表面积除以蛋白质岛总面积的总和。图5B显示了岛屿规模分布的明显增长趋势。蛋白质岛的平均面积从24μm2(35分钟)增加到57μm2(60分钟)。通过使用30帧/秒的更快扫描速率(支持信息中的电影S1,其中电影中的图像显示速度比实时慢10倍)也观察到蛋白质岛的运动,并且观察到蛋白质岛表现出类似于单层脂质结构域布朗运动的运动。42重要的是,观察到邻近岛屿在接触时结合在一起。富含蛋白质的结构域的存在表明蛋白质和表面活性剂在动力学过程中共同吸附到界面。蛋白质分子之间的强相互作用促进了结构域的形成和结构域的合并,从而阻止了表面活性剂的置换。然而,F-127的界面占有率在热力学上是有利的,其中F-127在0.015 mg/mL时的平衡表面张力约为40 mN/m43,而HSA在0.50 mg/mL时的平衡表面张力为52-60 mN/m。34因此,随着时间的推移,蛋白质结构域逐渐被表面活性剂从本体中置换,以降低表面能。
表面活性剂穿透蛋白质结构域的观察和表面活性剂富集区的扩展符合造山模型。该模型表明,表面活性剂首先穿透蛋白质层,形成缺陷或孔洞,从而取代界面上的蛋白质。然后,随着表面活性剂继续在这些区域累积,表面活性剂区域扩张,蛋白质层被迫弯曲并延伸到亚相,直到蛋白质层最终坍塌。1,19在肺表面活性物质/聚乙二醇/白蛋白混合物中显示了不同的置换机制,这表明竞争吸附过程可能依赖于系统。在表面张力和表面流变学研究中,44个理论模型已被开发用于解释蛋白质/表面活性剂混合溶液的吸附动力学和平衡状态。41作为对这些研究的补充,我们的工作提供了关于蛋白质和表面活性剂在界面上的位置以及组装结构的更详细信息。在我们的研究中观察到的聚结现象表明,相邻的蛋白质结构域有重组连接网络的趋势,而其他蛋白质正被表面活性剂取代,因此突出了HSA-TR/F-127混合物中蛋白质结构域聚结和表面活性剂取代蛋白质的两个竞争过程。
应用荧光显微镜研究了蛋白质在气-水界面的组装——结论、致谢!










