合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 如何准确地测量高粘度涂料的表面张力【亲身经历】
> 界面张力作用下泥质钻渣泥化黏附机理分析
> 表面张力低至26 mN/m以下,可提高深层煤岩气解吸量
> 基于阴离子−非离子型表面活性剂复配最佳强化润湿高效驱油体系——结果与讨论、结论
> 基于阴离子−非离子型表面活性剂复配最佳强化润湿高效驱油体系——实验部分
> 基于阴离子−非离子型表面活性剂复配最佳强化润湿高效驱油体系——摘要
> 不同助剂及浓度对IDK120-025型和LU120-015型喷头雾化效果的影响(四)
> 不同助剂及浓度对IDK120-025型和LU120-015型喷头雾化效果的影响(三)
> 不同助剂及浓度对IDK120-025型和LU120-015型喷头雾化效果的影响(二)
> 不同助剂及浓度对IDK120-025型和LU120-015型喷头雾化效果的影响(一)
激光加热引起表面活性剂在水面上产生位移——摘要、介绍、实验部分
来源:上海谓载 浏览 1851 次 发布时间:2021-12-27
摘要
我们报道了一项联合振动和频率产生(SFG)光谱、布鲁斯特角显微镜(BAM)和椭偏仪研究不同表面活性剂在水中作为表面活性剂密度的函数。在朗缪尔槽中测量了表面活性剂在表面活性剂CH和水OH拉伸区的振动SFG光谱。在低密度下,表面活性剂存在时产生的SFG信号与清水中产生的SFG信号无法区分−空中接口。当表面活性剂密度增加时,即在压缩单分子层时,观察到CH和OH光谱区域的SFG信号突然增加。对于更高的激光通量,这种逐步增加发生在表面活性剂密度越来越高的情况下。由于BAM表明,表面活性剂分子在这些低密度下明显存在,因此我们得出结论,在低表面活性剂密度下,激光束在液体膨胀相中将相对高密度的区域与表面活性剂置换出激光聚焦区域。这是由于在1 kHz的重复激光激发下,顶部为单层的水相局部加热引起的热梯度的结果。它可以通过使用旋转槽绕过。通过这种方式,可以刷新采样的表面积,从而可以将无伪影的振动SFG光谱测量到最低的表面活性剂密度。在椭偏仪实验中,可以注意到一个类似的步骤,然而,这是一个不同的性质;i、例如,它与加热无关(激光注量很低,光不共振),而是与分子跃迁有关。椭偏仪中每一分子面积的函数步骤的出现,关键取决于单层膜的制备。在制备单分子膜的过程中,通过给分子留出时间和空间使其松弛,也可以消除这一步骤。
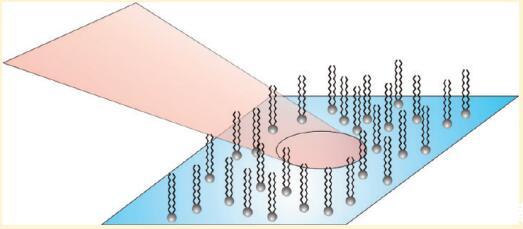
介绍
在过去的几十年中,红外-可见和频发生(SFG)已被证明是研究水相表面活性剂的极好工具。1.−9在该技术中,红外激光束与可见激光束在感兴趣的界面处组合,并检测两者的和频光束。在中心对称介质中,信号的产生通常是被禁止的,因此对界面上分子的存在非常敏感。如果红外激光与界面分子的振动跃迁共振,则SFG强度增强,从而可以测量界面分子的振动光谱。SFG光谱的形状包含有关表面活性剂的分子构象和方向的信息。大多数研究都集中在高密度单分子膜上,尽管在低密度下有令人惊讶的观察报告。我们中的一些人(Roke等人4)以前曾报告过C−H不溶性表面活性剂DPPC(1,2-二棕榈酰-sn-甘油-3-磷酸胆碱;见图1)在水上的拉伸模式,密度约为100Å2/分子,密度间隔小于1Å2/分子,这归因于脂质尾部的卷曲和未卷曲。最近,Chen等人9报告了DPPC在水和含有低二甲基亚砜摩尔分数的水上的CH信号在该密度附近的类似行为。此外,他们报告说,来自DPPC头部总成的P=O振动信号仅在CH信号存在时出现。他们将CH信号的缺失/存在归因于DPPC分子的无序/有序尾部。P=O信号的缺失可通过头部大的取向分布来解释。
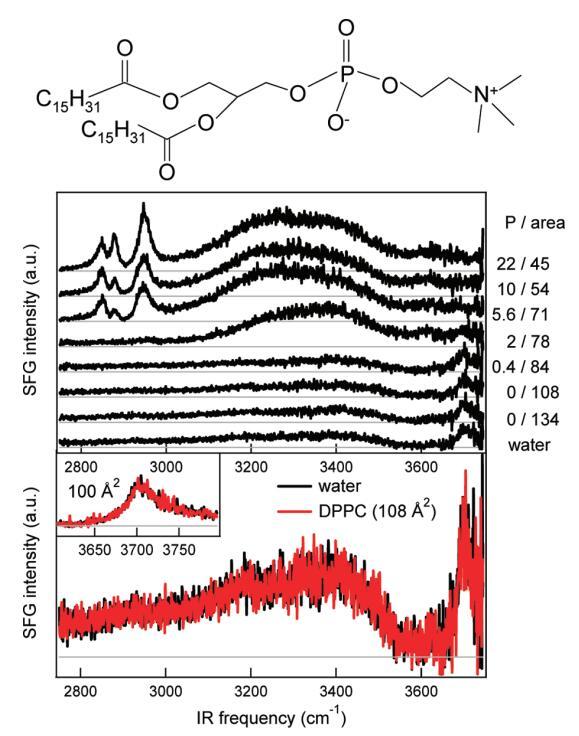
图1。顶板:DPPC的分子结构。中间面板:裸露水面(底部光谱)和密度增加的水中DPPC的SSP极化SFG光谱。压力(mN/m)和每个分子的面积(Å2)分别从底部到顶部增加和减少,在图表旁边给出。每个分子的面积由氯仿溶液滴的数量控制。CH(2800)−3000厘米−1),氢键OH(3000−3600厘米−1),还有免费的哦(∼3705厘米−1)拉伸振动可见。底部面板:从裸露水面的中间面板放大,每个分子的DPPC为108Å2,以表明它们的相似性。插图放大了裸露水面和DPPC(100Å2)表面的自由OH拉伸振动区域。在每个分子的这个区域,压力仍然低于检测极限,表面上DPPC的存在显然不影响自由OH拉伸振动的振幅。相对较高的红外通量(∼10 mJ/cm2)用于本实验。
虽然这些解释与数据一致,但对于所有模式,脂质信号消失可能有些令人惊讶;即使对于脂质卷曲的高度无序的单层,对称性也会被破坏,这仅仅是因为(可能是中心对称的)脂质层两侧的水和空气的介电常数不同。Roke et al.和Chen et al.都是基于C−H和P=O拉伸区域,即,源自脂质的模式。氢键水信号以前从未被研究过,它将使人们对观察到的现象有更多的了解。人们可能会认为,如果密度发生变化,水信号也有助于理解脂质的组织。特别是,这个问题提出了水结构如何受到可能无序脂质的影响。水中氢键水的信号−如果存在表面活性剂,则空气界面通常较大,其中水SFG信号的强度取决于表面活性剂的类型。10−12因此,在压缩脂质层时,预计水带中会发生变化。此外,自由OH预计会在压缩单层时受到影响,正如之前所看到的自由OD。13在这里,我们同时测量了DPPC单层在不同密度下的表面活性剂和水分子。在传统的SFG实验中,样品库是固定的,随着脂质密度的增加,光谱会发生阶跃转变,与水的光谱无法区分−空气界面到一个具有更强烈的水光谱和CH模式的界面。在水光谱中观察到的强度阶跃与来自表面活性剂的CH信号完全相关。当样品贮存器连续移动时,该强度步骤不存在。
通过使用布鲁斯特角显微镜(BAM),我们将表明,尽管表面活性剂在SFG中是不可见的,但它确实以非常低的密度存在于表面。BAM非常适合于在水面上显示密度相对较高的表面活性剂区域。在布鲁斯特角(∼对于使用HeNe激光器的水,p偏振光的反射消失。然而,如果表面存在表面活性剂或脂质结构域,则可以看到它们,因为它们确实在布儒斯特角反射一些光。
在此,我们研究了SFG信号中观察到的不连续性在多大程度上是由测量方式引起的。我们发现,SFG在某些条件下具有侵入性:在低表面活性剂密度(即每分子面积>100Å2)下,共振红外(IR)激光脉冲对水面层的重复加热导致高密度表面活性剂区域因热梯度诱导的流动而从激光焦点处移位。在较高的平均表面活性剂密度下,激光诱导的热梯度不再足以使畴远离激光焦点,信号突然增加。这解释了先前在低密度下观察到的单分子膜SFG信号的不连续性。为了概括我们的结论,我们表明这种行为不仅在脂质单层中观察到,而且在其他表面活性剂类型中也观察到。我们研究了一种脂肪酸(棕榈酸)和一种醇(1-十二醇)。此外,我们还报道了DPPC在低密度水中的真实无创SFG光谱(∼300Å2/分子)至高密度(∼50Å2/分子),通过使用旋转槽。这些新结果显示SFG信号逐渐增加。
令人惊讶的是,在通过椭偏法获得的椭圆度系数中,在低密度下也经常观察到脂质和脂肪酸的类似步骤。14−18椭偏仪基本上是BAM的空间整合版本;i、例如,代替二维图片,获得椭圆系数。我们认为,椭偏测量中观察到的强度阶跃与SFG中的阶跃具有不同的起源。单分子膜的加热可以忽略不计,因为在椭偏仪中,激光与水不共振,且通量较低。我们发现,与SFG相比,椭圆偏振法的步骤取决于样品制备。通过给分子时间和空间来放松,我们也可以消除这个步骤。
实验部分
对于SFG实验,宽带红外脉冲(fwhm)为∼200厘米−1)由泵送的OPG/OPA(TOPAS,光转换)产生∼来自相干Legend激光系统的1 W 800 nm脉冲(1 kHz,∼120 fs半高宽)。同时,,∼0.5 W的激光输出通过标准具,产生窄带VIS脉冲(12 490 cm−1.∼30μJ,半高宽带宽∼15厘米−1)提供实验的光谱分辨率。宽带红外脉冲允许同时检测多种振动模式。红外脉冲的中心是∼3100厘米−1(∼6μJ)用于检测CH和氢键OH振动的实验,并且∼3700厘米−1(∼3μJ)用于游离OH实验。对于一些实验,红外中心频率在2750到3750厘米之间连续变化(“扫描”)−1同时测量CH和全OH区域。从2750到3750再回到2750厘米大约需要一分钟的时间−1.可见光和红外光束的入射角分别为,∼35°和∼相对于表面法线为40°。可见光光束聚焦到约400μm的束腰。在两次实验之间改变了红外焦点。大多数实验都是在红外焦点大小为的情况下进行的∼200μm高斯光束束腰,产生∼10兆焦耳/平方厘米。对于低通量(∼1.5 mJ/cm2)实验(图5和图7,顶部面板),我们移动红外透镜,以使样品处的光束束腰减小∼SFG光通过单色仪进行光谱分散,并通过电子倍增电荷耦合器件(EMCCD和或技术)进行检测。在单层压缩过程中,在固定的红外频率下,以30秒的采集时间连续测量SFG光谱。在红外频率在2750到3750厘米之间扫描的实验中,采集时间为6(高通量)或10(低通量)分钟−1.除非另有说明,否则SFG光谱在s偏振SFG、s偏振VIS和p偏振IR条件(SSP)下记录,并标准化为取自z切割石英的参考光谱。
对于布鲁斯特角显微镜(BAM),使用配备50 mW 532 nm激光器的自制机器。19 p偏振光在表面上以大约布儒斯特角反射(∼53°)并通过显微镜接收。由于单层在可视化轴上倾斜,图像仅聚焦在窄条上。为了获得足够大的图像,然后将通过在单层上不同水平聚焦形成的不同条带的图像并排放置。由此获得了600μm×600μm的大图像,空间分辨率接近1μm。
使用两种不同的椭偏仪进行椭偏测量。一个是在布鲁斯特角工作的自制偏振调制机器(∼53°),并配备一台产生5 mW 632 nm光的激光器。另一种是商用零椭偏仪(Optrell),在50°角下以2 mW 632 nm的激光入射。对于椭偏仪和BAM,照明面积均为几平方毫米。
表面活性剂DPPC(1,2-二棕榈酰-sn-甘油-3-磷酸胆碱)、1-十二醇(C12H25OH)和棕榈酸(C15H31COOH)分别从Avanti极性脂质、Fluka和Sigma-Aldrich中获得,使用时无需进一步纯化。单分子膜从氯仿溶液(DPPC)中扩散∼0.5毫米,1-十二醇∼3毫米,棕榈酸∼2毫米)在空气中−H2O(微孔,18MΩcm)界面。通过两种方法制备具有不同表面密度的单分子膜:通过在水面上散布0.5μL液滴的数量或通过压缩该层来控制每个分子的面积。使用商用(芬兰Kibron Inc.)张力计,使用指针测量表面压力。由于椭偏测量结果取决于单层制备的方式,我们为每种类型的实验提供了制备的明确描述。
SFG。在我们连续扫描红外频率以立即获得整个CH和OH光谱的实验中,使用了自制的7×7 cm2特氟隆涂层槽(图1和图7,底部面板)。对于在激光发射之间(部分)刷新样品的实验,使用自制的圆形(直径8 cm)特氟隆槽(图5和图6)。该槽使用一个简单的12 V直流电动机旋转,该电动机驱动一个自制的旋转台,其旋转方式使样品在激光焦点处以100%的速度移动∼0.06 m/s。在这两种情况下,每个分子的面积由散布在水面上的0.5μL液滴的数量控制。对于要求每个分子的面积具有高分辨率的实验(图2),我们使用了6×23 cm的商用金属朗缪尔槽(芬兰Kibron公司)。用一个速度在5至10 mm/min之间的屏障压缩该层(∼1.3−2.6Å2/链/分钟)。每个分子的初始面积由表面活性剂氯仿溶液中0.5μL液滴的数量控制。
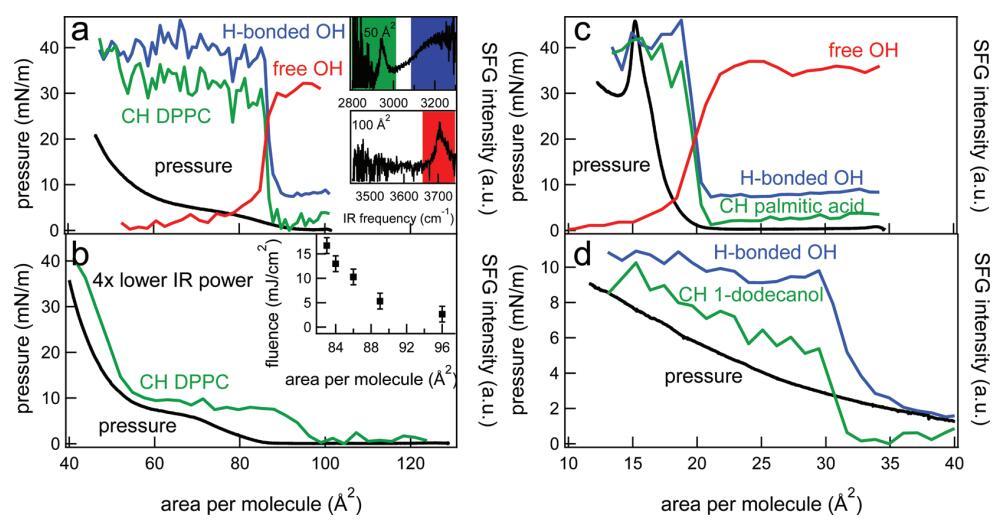
图2。(a)DPPC的CH信号(绿色)、氢键OH信号(蓝色)和自由OH信号(红色)的表面压力(黑色,左轴)和积分SFG强度(右轴),作为连续压缩单层过程中每个分子面积的函数。为了清晰起见,集成SFG信号被归一化,并且彼此之间具有小偏移。集成光谱区域由插图中的彩色正方形标记,分别显示CH/OH键合和游离OH区域中每个分子50和100Å2的SFG光谱。相对较高的红外通量(∼已使用10 mJ/cm2)。(b)与(a)类似,但红外功率降低了四倍,导致通量降低了四倍(∼2.5 mJ/cm2)。插图显示了改变红外注量对SFG信号出现的每个分子面积的影响。(c)类似于(a),但适用于棕榈酸。(d)类似于(a),但对于1-十二醇。在这种情况下,未测量1-十二醇的游离OH。SFG结果是在SSP极化下获得的。
砰。在布鲁斯特角显微镜(BAM)实验(图3)中,使用了面积为324 cm2的聚四氟乙烯槽。在沉积液滴后,每个分子的面积为150Å2,通过用一个屏障压缩单层来控制层的密度。在一定密度下,停止屏障以收集图像。
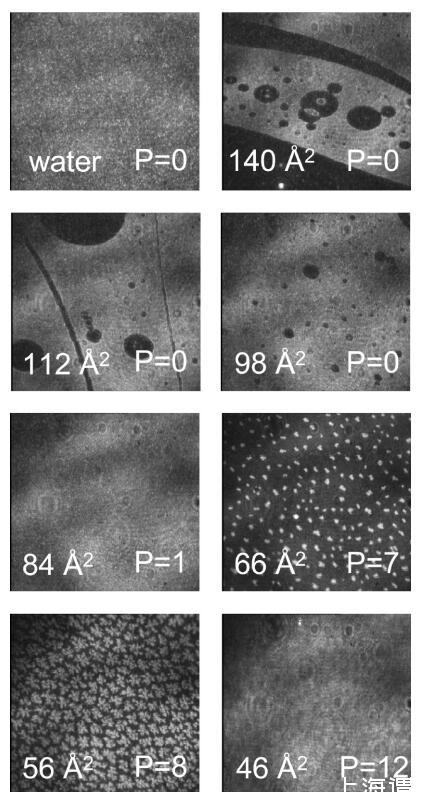
图3。水上不同密度DPPC的布儒斯特角显微镜图像。图像大小为600×600μm。白色区域表示高密度,而黑色区域表示低密度。在每个面板中,每个分子的面积(单位为Å2)在左下角报告,表面压力(单位为mN/m)在右下角报告。这些照片是用自动调整灵敏度的相机拍摄的,这样就无法比较图像之间的灰度等级。
椭偏仪。在一组实验中,在最初沉积氯仿溶液液滴后,通过在6×23 cm的商用金属朗缪尔槽(Kibron Inc.,芬兰)中以5 mm/min的速度压缩该层,并使用一个屏障(图8a和8c)来控制表面积。在另一个实验中,每个分子的面积由在自制的圆形(直径8 cm)特氟隆涂层槽(图8b)中水面上散布的0.5μL液滴数量控制。如下所示,对于以不同方式制备的单分子膜,可以获得不同的结果。










