合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(三)
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(二)
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(一)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(四)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(三)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(二)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(一)
> 表面张力实验、接触角实验分析抑尘试剂对煤的润湿结果
> Kibron表面张力仪研究烧结矿聚结行为
> 基于界面张力和表面张力测试评估商用UV油墨对不同承印纸张的表面浸润性差异(三)
LB膜分析仪-PPI多聚磷酸肌醇磷脂的应用(下)
来源:上海谓载 浏览 1297 次 发布时间:2022-06-27
结果
纯天然PIP2的相行为。通过将PIP2单分子膜从250Å2/分子压缩至50Å2/分子,并观察压缩对界面表面压力的影响,研究了纯天然衍生PIP2的表面压力(π)与分子面积之间的关系。10个单独试验的平均等温线如图1a所示。正如纯PIP2酰基链的已知组成所预期的那样(∼50%不饱和,33%花生四烯酸),随着分子面积的减小,这些等温线显示出表面压力平滑、单调的增加。在这些实验中使用的任何条件下,均未观察到PIP2单分子膜的相变。与生理条件相对应的表面压力下PIP2的平均面积(∼30 mN/m 27)为73.1(3.0Å2/分子,略大于SAPC(65Å2)的公布值,28这是根据糖头基的添加体积和静电排斥预期的。尽管在生理pH下PIP2头基的大小和相对较高的电荷密度,但该分子很容易形成紧密压缩的单分子膜,而不是在较高的表面压力下坍塌成水胶束结构。在所有条件下,由于屏障泄漏或单层崩塌导致的脂质损失导致的单层迟滞可以忽略不计,类似于SOPC等对照脂质(数据未显示)。
离子强度增加对PIP2单分子膜的扩展效应。为了研究离子强度对PIP2单分子膜行为的影响,在亚相不同浓度的NaCl下取了π-A等温线。在高于5 mN/m的所有表面压力下,添加NaCl可显着扩展单分子膜(图1a)。在预先形成的PIP2单层的亚相中加入NaCl时也观察到了这种反应。在恒定分子面积下,添加250 mM NaCl后,表面压力增加,其大小与等温线实验中观察到的大小相当,在扩散限制时间尺度上(图1a插图)。在π)30 mN/m时,每个PIP2分子的面积增加了13%,达到82.5Å2/分子(图1b)。该效应的剂量反应量化表明,该效应在约200 mM NaCl下饱和,并在生理相关盐浓度范围内显示出显着变化(图1c)。

图1:。NaCl对PIP2单分子膜的扩张效应。(A)π-含0 mM(9)和250 mM NaCl(2)的等温线;(插图)亚相注入250 mM NaCl(时间)0时,恒定面积/分子的表面压力变化。(B)在pH 1.8(n)7)和pH 7.4(n)5)条件下,30 mN/m的每个分子的面积。(C)对亚相NaCl的剂量反应。误差条为平均值(n处为SE)5,除非另有说明。所有数据均为HEPES缓冲亚相的L-R PIP2,pH 7.4(除非另有说明),30°C。
为了测试静电机制(如反离子云排斥)导致单层膨胀的可能性,使用与PIP2实验相同的条件,测量了250 mM NaCl对另一种带电脂质L-R PS的影响。PS的单分子膜与PIP2的单分子膜没有受到相同的影响,相反,随着亚相离子强度的增加,PS的单分子膜表现出非常轻微的收缩(图2a)。
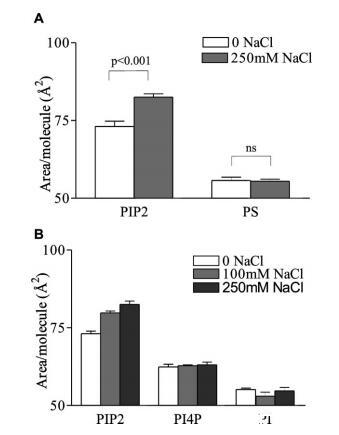
图2:。盐膨胀效应对PIP2的特异性。(A)L-R PIP2和L-R PS的每分子面积;和(B)HEPES缓冲亚相上的L-R PIP2、L-R PI(4)P和L-R PI,pH 7.4,π)30mN/m下的30°C。平均值(SE,n)4。
为了确定PIP2特异性膨胀是否主要由大块肌醇环引起,同时控制酰基链组成,用磷脂酰肌醇4-磷酸(LR PI(4)P)和磷脂酰肌醇(LR PI)重复压力面积等温线。由于这些分子是细胞中酶促PIP2生成的前体,它们的脂肪酸组成与PIP2相似或相同,只是在肌醇环上的磷酸取代程度不同。与PIP2一样,两种肌醇基脂质均未观察到相变,平均分子面积随着磷酸取代度的增加而增加,与之前的观察结果一致。29然而,尽管单磷酸盐PI(4)P与二磷酸盐PIP2表现出相同的趋势,但PI和PI(4)P均未表现出对NaCl浓度增加的显着扩张,表明类似但小得多的影响(图2b)。这些数据表明,NaCl诱导PIP2单分子膜扩张的机制与其他阴离子以及其他肌醇基脂质相比,是PIP2特有的。
与其他阴离子磷脂相比,除了NaCl对PIP2的扩张效应具有特异性外,该效应还依赖于PIP2异构体。对肌醇环(3和5、4和5、3和4)上不同位置被取代的合成PIP2类似物的分子面积进行量化表明,分子面积不仅取决于磷酸盐的位置,而且NaCl诱导膨胀的大小也受磷酸单酯在三种不同异构体中的位置的影响(图5a)。对这种膨胀的直接比较表明,对于PI(3,5)P2,0和250 mM NaCl之间的差异最大(∼22Å),然后是PI(4,5)P2(11Å2)和PI(3,4)P2(5Å2),并且PIP2异构体之间的差异在统计学上非常显著(p<0.001)。
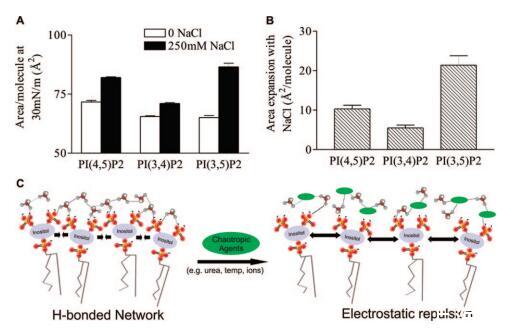
图5:。亚相氯化钠膨胀效应的PIP2异构体特异性。(A)HEPES缓冲亚相上的DO-PIP2异构体在π)30 mN/m时的每分子面积。平均值(SE,n)7。(B)250 mM NaCl和无亚相NaCl之间DOPIP2异构体的每分子面积差异。通过双向ANOVA测量,NaCl效应的异构体依赖性显着达到p)0.0001。(C)PIP2分子间相互作用的概念动画。在没有潮向性试剂(绿色椭圆)的情况下,PIP2分子形成水介导的氢键网络。当添加潮向性聚合物时,网络被破坏,带电磷酸盐之间的静电排斥导致单层的膨胀。
不同反离子的影响。为了确定单价盐对PIP2单分子膜的扩张效应的离子特异性,测试了其他阳离子反离子的效应。在250 mM时,所有测试的单价阳离子(Na+、K+、Li+、Cs+)显示出类似的、统计上显着的PIP2单分子膜扩展,其影响程度与离子的电荷密度直接相关,即Li+>Na+>K+≈Cs+(图3a,p)0.15-0.3,因为数据集有限,离子之间的差异)。这里观察到的电荷密度依赖性不同于盐诱导的低电荷阴离子磷脂单分子膜的膨胀,在盐诱导下,没有观察到阳离子依赖性或相反的趋势。30与PG相比,不同阳离子引起的PIP2膨胀的幅度30似乎与描述离子潮向性的Hofmeister级数直接相关(参考文献31)。这一结果表明,除了对头基质子化产生影响外,这些离子还可能破坏单分子层内多分子水介导氢键网络的结构。

图3:。各种反离子的影响。(A)用250 mM盐缓冲HEPES亚相上的L-R PIP2在π)30 mN/m处的每分子面积;平均值(SE,n)5。(B)π-L-R PIP2 HEPES缓冲亚相的面积等温线,pH 7.4,30°C(实线),相同条件加250 mM CaCl2(虚线);(插图)250 mM CaCl2和MgCl2影响的量化;平均值(SE,n)4。
与单价盐相比,二价反离子对PIP2的影响非常不同。CaCl2和MgCl2对纯PIP2单分子膜都有很大的冷凝作用(图3b)。图3b中的代表性等温线突出了这些差异,包括π)30 mN/m和较低表面压力下每PIP2的面积。插图显示了二价阳离子凝聚效应的量化,并表明含有250 mM Ca2+和Mg2+的PIP2单分子膜分别比对照压缩了15%和9%。这些结果与已知的Ca2+作为PIP2交联剂的能力一致,Ca2+以高亲和力结合和脱水多种磷酸盐,32,33中和其电荷,桥联头基以形成紧密凝聚的单分子膜,34即使在低表面压力下也是如此。
非离子液晶和温度的膨胀效应。为了验证单价盐破坏PIP2头基之间有吸引力的氢键相互作用的假设,部分克服了高头基电荷密度预期的静电排斥作用,测试了几种非离子超嗜性因子破坏这些假定网络和诱导单层膨胀的能力。尿素是一种因其潮向性而常用的蛋白质变性剂,海藻糖是一种非还原性葡萄糖二聚体,因其破坏水结构的能力而具有低温保护特性,对其对PIP2单层的影响进行了测试。与通过氢键的吸引相互作用相一致,两种非离子超取向对单分子膜都有很强的膨胀效应。在π)30 mN/m时,5 m尿素使每个PIP2分子的面积增加了近25%,达到90.9Å2/分子,这是在这些实验中所采用的任何条件下观察到的最高值(图4b)。同样,5 mM海藻糖显着增加PIP2单层的面积9%。这些作用对PIP2有特异性,因为两种处理对PI的单层都没有显着影响。
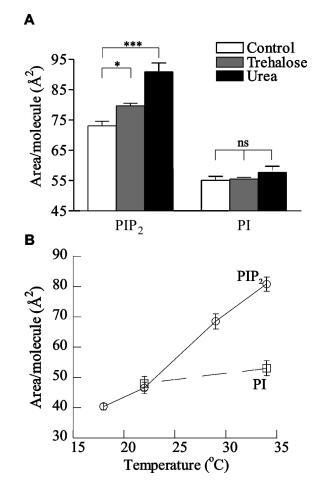
图4:。水介导分子间氢键的证据。HEPES缓冲亚相上的L-R PIP2和L-R PI在π)30 mN/m时的每分子面积,pH 7.4(A)存在5 mM海藻糖和5 m尿素,(B)作为亚相(O)PIP2温度的函数;0)PI)。
最后,为了验证氢键假设,对PIP2单分子膜的温度依赖性行为进行了测试。随着亚相温度从34°C降至17°C,这些单层显示出非常显着的收缩,每个分子的面积减少了近50%(图4a)。相反,PI的单层仅收缩∼在相同温度范围内为10%,与kBT压力的简单缩放一致。虽然由于脂质动能的降低,预计会出现一些收缩,但PIP2的50%差异强烈表明了另一种机制,如子相的热能增加会破坏氢键网络。纯PIP2在亚相温度以下不能形成压缩单分子膜∼15°C,相反,在相对较低的表面压力下(小于10 mN/m;数据未显示)出现坍塌。这一结果可能与理解温度诱导的细胞结构变化有关,例如血小板的冷激活,在此过程中,质膜上PIP2组织的变化触发肌动蛋白组装。35 PIP2在低温下无法保持平面状态也可能与在4°C下溶解的细胞膜耐去污剂部分中存在PIP2有关,14通常与脂筏有关。因此,从低于15°C的结果中无法推断在较高温度下富含胆固醇的结构域中存在PIP2。
讨论
多磷酸肌醇是一种重要的信号中间产物,但人们对产生或降解这些脂质的酶的遗传调节和表达的了解要比决定这些脂质在质膜内分布或在不同细胞间转运的物理化学的了解多得多。由于它们带有很大的负电荷,人们似乎普遍认为,这些脂质在双层平面内仅表现出相互排斥的相互作用,除非它们与特定的蛋白质络合,否则会使它们分散。20,23,36一些证据表明,PPI在产生洗涤剂不溶性脂质组分的条件下被强烈隔离(通常被视为PPI定位于脂筏的证据14),而使用荧光能量转移方法的研究提供了氢键可能稳定富含PPI的簇合物的证据。24,25在这种情况下,目前的结果提供了PPI之间静电相互作用大小的定量估计,并表明由氢键介导的吸引相互作用显着抵消了静电排斥。
用纯静电机制很好地解释了PIP2的压力-面积等温线的一个特征是单价离子对表面压力的一般影响。尽管单价盐在PIP2单分子膜亚相中的膨胀效应可能与头基之间的静电排斥作用不一致(亚相离子可能会屏蔽阴离子头基,并允许更紧密的填充37,38),但亚相阳离子导致的单分子膜膨胀是由于磷酸单酯电离电位对离子强度的依赖性,先前显示磷脂酸单层。39这种效应在调节荷电单分子膜的凝胶-液体转变温度方面很重要,40尽管亚相盐与其他阴离子脂质的膨胀效应测量值远小于此处观察到的PIP2膨胀效应。30
最近,通过将系统建模为可电离基团的均匀分布平面,确定了纯静电对PIP2单分子膜表面压力的贡献,其电荷密度是可电离基团pKa和亚相溶液离子强度的函数。41通过区分热力学势与表面积的关系计算出的静电排斥引起的表面压力与一些观察到的实验结果定性一致。在中性pH下观察到的膨胀单分子膜(高达150Å2/分子)的高压可以用高电荷头基的排斥作用来解释。此外,中性pH下的静电模型证实了具有低离子强度和高离子强度的等温线之间的交叉以及由于高离子强度导致的单层膨胀(参考文献41中的图1a和图4b)。然而,许多实验观察到的结果与纯静电处理不兼容。具体而言,不同单价离子的不同影响不能完全通过亚相离子强度的变化来解释。NaCl诱导的单层扩张的PIP2异构体特异性以及不带电的潮向性和温度的影响也表明了比表观头基pKa的严格静电亚相离子强度调制更复杂的分子机制。此外,pH值为1.8时亚相盐的膨胀效应(图1b)与预测在所有磷酸单酯质子化的条件下没有静电效应的模型不一致(参考文献41中的图4f)。最后,在几乎所有情况下,实验测定的PIP2表面压力明显低于纯静电效应保守估计的预测值。
上述实验结果突出了吸引力相互作用的重要性,这种相互作用可能是由氢键介导的,可以显着对抗平面系统中PIP2脂质之间的排斥静电相互作用。这些有吸引力的相互作用可能会被一些朝潮性因素破坏,如单价离子、海藻糖或尿素。这些发现总结在图5c所示的定性模型中。在没有干扰剂的情况下,几个PIP2分子通过水介导的氢键网络相互作用。当存在破坏水-PIP2相互作用的离子因素或非离子超取向物时,氢键被破坏,静电排斥导致分子面积增加。该模型得到了单价阳离子对纯PIP2单分子膜扩展效应的大小以及尿素和海藻糖(强非离子向潮性)的影响的支持。建议的氢键状态和超临界膨胀状态之间的计算能量差(对于250 mM LiCl:∆面积)17.8Å2/分子(35 mN/m时)∼6 kJ/mol)与每个PIP2分子约一个氢键的损失相当。这种能量与PIP2和MARCKS之间的多价相互作用能具有相同的尺度(∼16千焦/摩尔)。23混合脂质系统中PIP2头基之间存在分子间氢键的可能性已在实验24,25和模拟42中得到证实,本文提供的数据通过实验证实了这种可能性,实验表明氢键是PIP2分子间相互作用的一个重要因素。
温度对PIP2单分子膜的影响也表明这些脂质之间存在重要的非静电相互作用。随着温度的降低,表面压力的显着下降远远大于其他带电液相脂质的下降,并且不简单地与热能成比例。事实上,纯PIP2单分子膜在室温下的稳定性明显低于37°C,并且不能在15°C以下形成。PIP2单分子膜在低温下的崩塌可能与假设的PPI在低温下聚集有关,被认为会触发血小板的冷激活和可能的其他生物功能。35
对于观察到的亚相盐效应,静电学和氢键的另一种解释是,单价盐嵌入阴离子头基平面,在磷酸盐和阳离子之间形成网络晶格。这一解释似乎不太可能,因为膨胀最大的是最小、最正电的离子(Li+),而随着离子半径的增大而减小(图3a)。此外,尽管在没有盐的情况下形成波纹相可以产生更压缩的单层,但没有通过任何等温线观察到从液相到波纹相的相变(图1a)。此外,波纹相仅可能在高表面压力下形成,而在低至5 mN/m的压力下,高盐和低盐状态之间的差异很明显(图1a)。
有两条证据表明水在维持这种网络中的重要性,而不是相邻PIP2分子之间的直接氢键。预计不会与磷酸基团相互作用的非离子溶质尿素和海藻糖对PIP2单分子膜具有强烈的扩张效应,这可能是由于它们破坏了水结构并随后干扰了氢键网络(图4a)。其次,二价阳离子(Ca2+和Mg2+)诱导的PIP2每个分子面积的显着减少证实了它们能够桥接相邻脂质,从而导致界面脱水,并表明尽管PIP2单分子膜通过氢键能力保持压缩状态,它们不像被二价阳离子直接交联时那样被紧密压缩(图3b)。
许多实验表明,PIP2的许多细胞结合伙伴至少有两种不同的相互作用模式。一些蛋白质(例如,含有PH结构域的蛋白质)对单个PIP2分子有一个特定的结合位点,43–45,而其他蛋白质则含有非结构化的多元酸结构域,被认为可以通过非特异性静电吸引同时结合多个PIP2分子(例如,MARCKS23,46)。考虑到细胞可能通过影响氢键和静电排斥之间的平衡来调节PIP2介导的信号传导,从而调节可用于单个脂质结合蛋白域的PIP2池与可用于结合多分子组装的PIP2池,这似乎是合理的。
确认。这项工作得到了MRSEC第05-20020号赠款(I.L.和P.A.J.)和富布赖特基金会(A.C.)的资助。










