合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 阳-非离子复合表面活性剂体系表面张力测定及基础性能评价(三)
> 阳-非离子复合表面活性剂体系表面张力测定及基础性能评价(二)
> 阳-非离子复合表面活性剂体系表面张力测定及基础性能评价(一)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(三)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(二)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(一)
> 界面流变仪可以测量液体表面张力吗?界面流变仪与界面张力仪区别解析
> 测量表面张力/界面张力的仪器有哪些?怎么选
> PG脱酰胺添加量对玉米醇溶蛋白气-水动态表面张力的影响
> 芬兰Kibron表面张力仪使用指南【专业版】
细胞膜表面张力调控方法与步骤
来源:南京邮电大学 浏览 1278 次 发布时间:2024-03-11
细胞膜是由蛋白质与胆固醇等分子镶嵌在磷脂中的典型双分子层结构。细胞膜仿生技术已经成功实现在纳米颗粒以及纳米液滴表面修饰组装,并实现体内的长循环以及良好生物相容性。典型的细胞膜仿生技术是将剥离后的细胞膜直接以磷脂双分子层的形式包被于纳米颗粒或液滴表面。然而由于表面张力作用,细胞膜的磷脂双分子层无法直接包被在微米级的气泡表面。
本发明采用反复液氮冷冻-室温融化的方式向血小板膜中掺杂磷脂并得到血小板膜冻融复合物囊泡。通过Langmuir-Blodgett膜天平测试得到冻融复合物中的磷脂蛋白质分子在气液界面的表面张力显著降低,通过差适量热扫描技术测试表明掺杂后的血小板膜玻璃态转变温度降低。利用超声辅助的方式向血小板膜冻融复合物囊泡中鼓入六氟化硫气体,在气液界面形成血小板膜冻融复合物微泡。通过荧光标记的方式定位血小板膜蛋白,并成功示踪其融合在血小板膜冻融复合物微泡。通过对血小板膜冻融复合物囊泡以及血小板膜冻融复合物微泡进行蛋白质组学分析,发现血小板膜冻融复合物微泡继承了血小板膜冻融复合物囊泡61.4%的蛋白质种类,并维持了血小板膜表面的整合素αIIβ3活化的构象。在大鼠下腔静脉急慢性血栓模型实验中,血小板膜冻融复合物微泡能够特异性识别急性血栓,其对于急性血栓诊断平均信噪比为12.47 dB,而慢性血栓为0.1dB。
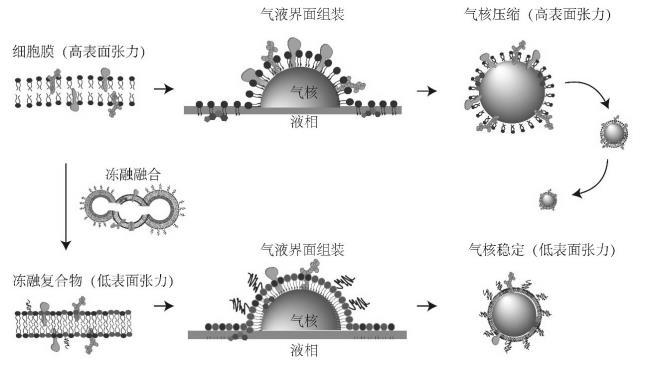
细胞膜表面张力调控方法示意图;

不同磷脂配方的脂质体对气液界面表面张力调控效应的表面压力与面积等温曲线图;

不同蛋白质与磷脂质量比对气液界面表面张力调控效应图:A为牛血清白蛋白与磷脂在气液界面组装的示意图;B为不同蛋白质与磷脂质量比的气液界面表面压力与面积等温曲线图;C为不同蛋白质与磷脂质量比的表面张力值;
实施例:
1、血小板膜的提取:
首先从人、大鼠、小鼠、兔、牛、猪的全血中选取血小板,所选的磷脂为二棕榈酸磷脂酰胆碱、二硬脂酸磷脂酰乙胺醇-聚乙二醇2000、硬脂酸、二硬脂酸磷脂甘油的组合;然后,在全血提取出的血小板中,加入终浓度为42 mM的甘露糖、终浓度为1μM的前列腺素E1,和磷酸酶蛋白酶抑制剂混合物,得到浓度为2×108
个/mL的血小板悬液。将血小板悬液在-80°C冰箱中冷冻1小时,随后在37°C恒温水浴箱中融化,反复三次后于4°C,12000g条件下离心15分钟得到血小板膜悬液,并用BCA蛋白定量试剂盒定量蛋白质浓度,用磷脂试剂盒定量磷脂浓度。
2、磷脂的制备:
磷脂按照二棕榈酸磷脂酰胆碱、二硬脂酸磷脂酰乙胺醇-聚乙二醇2000、硬脂酸、二硬脂酸磷脂甘油的以一系列质量比例溶解在体积比为1:1的氯仿和甲醇中,于50℃,100rpm的条件下旋蒸直到圆底烧瓶底部出现一层均匀的薄膜,取下烧瓶,真空干燥8小时。往干燥后的烧瓶中加入磷酸缓冲液并在50℃、100 w、53 kHZ的条件下水浴超声得到脂质体膜溶液,并调节脂质体膜溶液的PH为7.4。将血小板膜与脂质体在不同的蛋白质磷脂质量比例下进行混合。将混合物在液氮和室温下反复冻融6次得到血小板膜冻融复合物。将血小板膜或血小板膜冻融复合物转移到置于冰上的10 mL玻璃瓶中,将六氟化硫气体吹入系统,用探针超声处理(300 W,5 s开/5 s关)将六氟化硫气体分散到水性介质中4个循环分别得到血小板膜纳泡以及血小板膜冻融复合物微泡。
3、蛋白质磷脂复合物气液界面张力调控:
采用Langmuir-Blodgett多功能膜天平测量所制备磷脂复合物在气液界面处的表面张力。用微量注射器将20µL磷脂(1mg/mL脂浓度)氯仿溶液涂在Langmuir-Blodgett多功能膜天平上,使氯仿蒸发10分钟。将表面的初始面积设置为282 cm2
,并在20℃下以10 mm/min的速率压缩薄膜,记录表面张力-表面积曲线。如图2所示在一系列磷脂配方中,DSPE-PEG2000
的摩尔百分比为10%时在气液界面具有最低的表面张力(3mN/m),DPPC:DPPG:DSPE-PEG2000
的比例为8:1:1的时候气液界面的的表面压力达到69mN/m,因此具有最低的气液界面表面张力(2mN/m)。为了探究蛋白质与磷脂在气液界面组装的规律,如图3中的A所示,选用牛血清白蛋白(BSA)作为标准蛋白质,配置好一系列不同蛋白质与磷脂质量比的磷脂蛋白质复合物,并用微量注射器将20µL磷脂蛋白质复合物(1mg/mL脂浓度)氯仿溶液涂在Langmuir-Blodgett多功能膜天平上,使氯仿蒸发10分钟。将表面的初始面积设置为282cm2
,并在20℃下以10 mm/min的速率压缩薄膜,记录表面张力-表面积曲线。如图3中的B以及C所示在一系列具有不同质量比的磷脂蛋白质复合物中当蛋白质比磷脂的质量比为0.02时具有最低的气液界面表面张力。
4、血小板膜-磷脂融合验证:
分别用过量的DiO和DiI对血小板膜囊泡和脂质体进行染色,随后用12000 g,15min,4℃的条件去除未嵌膜的染料。按照不同蛋白质:磷脂质量比添加两种膜材并在37℃恒温箱中共孵育30分钟,取出后在液氮中放置1分钟,随后放置于37℃融化,重复该循环5次。冻融循环后的冻融复合物溶液置于冰上,用功率为10 w,频率为25 Khz的探头超声,控制超声5秒开时间,5秒关时间,总时间为2分钟,得到荧光标记血小板膜冻融复合物囊泡。在3 ml的石英比色皿加入2 ml水和20 ul样品,用460 nm波长的激光作为激发光,接收480-680 nm的发射光。如图4中的A所示由于DiI与DiO分子在距离小于10 nm时会发生Foster荧光共振能量转移(FRET)现象,嵌在磷脂双分子层中疏水端的分子彼此接近且小于10nm可以证明血小板膜与脂质体的磷脂进行了相互的融合。如图4中的B所示,随着蛋白质与磷脂的质量比降低荧光共振转移现象逐渐明显,说明膜融合的程度增大。分别用过量的DiO和DiD对血小板膜囊泡和脂质体进行染色,随后用12000 g,15 min,4℃的条件去除未嵌膜的染料。将染色后的血小板囊泡以及脂质体在蛋白质与磷脂的质量比为0.02时分别通过混合孵育以及冻融两种方式进行融合,通过流式细胞术来观察两者融合效率,如图4中的C所示,当血小板囊泡与脂质体形成冻融复合物可以有效融合两种组分。取不同膜蛋白:脂质体的质量比的血小板膜冻融复合物微泡进行冻干,冻干粉进行差示量热扫描分析,扫描速度为5℃/min。如图5所示,随着掺杂磷脂的比例增加,血小板膜冻融复合物的玻璃态转变温度降低,在蛋白质与磷脂的质量比为0.02时候具有最低的玻璃态转变温度。血小板膜气液界面张力调控。使用冻融的方法向血小板膜中掺杂不同比例的磷脂,形成冻融复合物,其组分的构成如图6所示。向血小板膜中掺杂不同比例的磷脂,形成的血小板膜冻融复合物在气液界面的表面张力随着蛋白质与磷脂质量比的降低而降低,如图7所示血小板膜冻融复合物在蛋白质与磷脂的质量比为0.02时具有最低的气液界面表面张力。
5、血小板膜气液界面组装组分的定位:
血小板膜用Cy5.5进行蛋白标记,用于在气液界面组装过程中进行组分定位。将血小板膜、血小板膜冻融复合物或血小板膜和脂质体的混合物在SF6
气氛中超声乳化。得到的气泡用于流式细胞术分析,在FSC/SSC门控中分离所得气泡,并定量Q2和Q4区域的Cy5.5荧光,如图8所示,相对于血小板膜与脂质体的混合物使用血小板膜冻融复合物可以有效将血小板膜组分组装在微米气泡上。对于荧光定位分析,用Cy5.5标记血小板膜组分进行定向。将所有囊泡系统在超声处理前以12000g离心10分钟,超声处理后以50g离心10分钟,并通过小动物体内成像系统(IVIS)成像以检测Cy5.5信号。超声处理后,通过Zetasizer测量原始混合物和离心管中顶部或向下部分的粒径。如图9所示,使用血小板膜冻融复合物制备的微泡中检测到标记血小板膜的荧光分子Cy5.5。
6、制备过程产物形貌及电位表征:
采用透射电子显微镜对血小板膜、血小板膜冻融复合物、血小板膜纳泡和血小板膜冻融复合物微泡的形貌进行表征。将所有样品稀释至0.1 mg/mL(脂质浓度)。将10µL的血小板膜和血小板膜冻融复合物滴落到碳涂层铜网上。真空干燥15分钟后,用1%醋酸铀对样品进行负染。将10µL的PNBs和PMBs在室温下滴落在碳包覆的铜网格上2 h,使其吸附到碳膜表面。使用透射电子显微镜在100 kV的加速电压下检查所有样品。如图10所示,血小板膜(A)与血小板膜(C)具有典型的磷脂双分子层结构,而在血小板膜纳米泡(B)以及血小板膜冻融复合物微泡(D)具有典型的单分子层气泡结构。通过Zetasizer测量血小板膜、血小板膜冻融复合物、血小板膜纳泡和血小板膜冻融复合物微泡的水合粒径和zeta电位,如图11所示,血小板膜与血小板膜纳泡具有相似的zeta电位,在掺杂磷脂后血小板膜冻融复合物以及血小板膜冻融复合物微泡的zeta电位有明显降低降低为-47mV。
7、血小板膜冻融复合物微泡蛋白表征:
对制备的血小板膜冻融复合物与血小板膜冻融复合物微泡进行蛋白质组学分析,如图12所示,血小板膜冻融复合物微泡继承了血小板膜冻融复合物61.7%的蛋白质种类。将制备的血小板膜冻融复合物微泡与FITC标记的CD41抗体先涡旋混合2分钟,再放于37°C中缓慢搅拌孵育30分钟。平行组再用膜染料DiI非特异性地染磷脂,取出后在200g,2分钟的离心条件将微气泡与未结合的抗体分离。取微气泡稀释20倍后滴于带有凹槽的载玻片中,再盖上盖玻片,分别用484nm和559nm的激发光源拍摄共聚焦显微镜。如图13所示,在血小板膜冻融复合物微泡中来自血小板膜的绿色荧光与来自脂质体的红色荧光有效共定位。
8、血小板膜冻融复合物微泡糖蛋白αIIbβ3蛋白质构象分析:
收集的血小板静置在Tyrode缓冲液中(5×105
)。将血小板或血小板膜冻融复合物微泡与生理盐水或凝血酶(0.5 U/mL)在200µL终体积的Tyrode缓冲液中孵育15分钟。然后用10µL PE-JON/A抗体在室温下黑暗染色20 min,并在进行流式分析。免疫共沉淀实验中用0.5 U/mL凝血酶刺激小鼠血小板,加入裂解缓冲液终止反应。然后将活化的血小板裂解物、血小板裂解物、血小板膜冻融复合物裂解物和血小板膜冻融复合物微泡裂解物与抗β3抗体(50µg/mL)在4°C下孵育过夜。次日加入rProtein A/G磁珠吸收免疫复合物。将样品在磁架上分离,并用裂解缓冲液洗涤6次。使用SDS-聚丙烯酰胺凝胶电泳和含有β3和talin-1抗体的蛋白质印迹分析免疫沉淀。如图14所示,血小板膜冻融复合物微泡表面的糖蛋白αIIbβ3具有活化的构象,并且其活化不依赖血小板内的Talin-1蛋白。
9、急慢性血栓模型的构建:
用异氟烷麻醉大鼠,开腹后找到下腔静脉,并用一段长为4 mm,宽为2 mm的滤纸条泡在20%的三氯化铁中,取出后贴在下腔静脉表面,1分钟后取走滤纸条,并用PBS重洗该处,构建大鼠急性血栓模型。在慢性血栓模型中,大鼠的伤口缝合后在无菌环境下饲养10天,构建慢性血栓模型。
10、急慢性血栓模型的超声分子影像诊断:
超声造影设备采用GE公司生产的LOGIQ E9型全身应用超高端彩超,首先选用18MHz探头机械指数MI调节为1.0,在B模式下对下腔静脉进行造影,对血栓的大小及位置进行判断,在多普勒模式下对血栓处的血流进行造影。用5 ml注射器抽取5 ml生理盐水加入到血小板膜冻融复合物微气泡冻干粉中,用力震荡复溶形成血小板膜冻融复合物微气泡。将血小板膜冻融复合物微气泡通过尾静脉分别注射入大鼠的尾静脉中。再选用9 MHz的探头,机械指数MI调节为0.14,在对比增强模式(CEUS)下对下腔静脉进行造影,血管灌注及血栓靶向时的对比增强超声图像分析。连续采集5分钟内的图像,并使用MATLAB软件对图像感兴趣区域的信号强度进行分析,并根据超声强度的标尺来确定感兴趣区域的超声信号值。如图15所示,在急性血栓模型中,血小板膜冻融复合物微泡能够有效靶向急性血栓,因此有效低提高急性血栓诊断的超声信噪比。如图16所示,在慢性血栓模型中,血小板膜冻融复合物微泡在慢性血栓处无富集,其超声信噪比没有显著变化。通过对急性血栓以及慢性血栓进行苏木精-伊红以及马松染色分析证明二者组分有明显差异,在急性血栓中以纤维蛋白为主而在慢性血栓中以胶原为主,血小板膜冻融复合物微泡在二者诊断中的平均超声信噪比有显著性差异。
综上所述,本发明采用反复液氮冷冻-室温融化的方式向血小板膜中掺杂磷脂并得到血小板膜冻融复合物囊泡。通过Langmuir-Blodgett膜天平测试得到冻融复合物中的磷脂蛋白质分子在气液界面的表面张力显著降低,通过差适量热扫描技术测试表明掺杂后的血小板膜玻璃态转变温度降低。利用超声辅助的方式向血小板膜冻融复合物囊泡中鼓入六氟化硫气体,在气液界面形成血小板膜冻融复合物微泡。通过荧光标记的方式定位血小板膜蛋白,并成功示踪其融合在血小板膜冻融复合物微泡。通过对血小板膜冻融复合物囊泡以及血小板膜冻融复合物微泡进行蛋白质组学分析,发现血小板膜冻融复合物微泡继承了血小板膜冻融复合物囊泡61.4%的蛋白质种类,并维持了血小板膜表面的整合素αIIβ3活化的构象。在大鼠下腔静脉急慢性血栓模型实验中,血小板膜冻融复合物微泡能够特异性识别急性血栓,其对于急性血栓诊断平均信噪比为12.47 dB,而慢性血栓为0.1dB。










