合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 界面流变仪可以测量液体表面张力吗?界面流变仪与界面张力仪区别解析
> 测量表面张力/界面张力的仪器有哪些?怎么选
> PG脱酰胺添加量对玉米醇溶蛋白气-水动态表面张力的影响
> 芬兰Kibron表面张力仪使用指南【专业版】
> 平面流动皂膜表面张力系数、厚度和流动速度实验装置及测量方法(二)
> 平面流动皂膜表面张力系数、厚度和流动速度实验装置及测量方法(一)
> 单层膜界面上亚微米颗粒表面张力阻力系数修正——颗粒在单层膜上的阻力系数
> 单层膜界面上亚微米颗粒表面张力阻力系数修正——膜的性质及实验方法
> 单层膜界面上亚微米颗粒表面张力阻力系数修正——摘要、引言
> Kibron超微量天平在生物医药研究领域应用实例
诱导期测定法研究NaCl的添加对碳酸锂固-液界面张力等成核动力学参数影响——实验部分
来源:高等学校化学学报 浏览 459 次 发布时间:2025-02-14
摘要
在288.15~323.15 K温度范围内,采用诱导期测定法研究了碳酸锂(Li2CO3)在有无添加NaCl的LiCl-Na2CO3过饱和溶液中的成核动力学.通过OLI电解质与水化学物性分析软件内嵌的全组分模型严格计算Li2CO3在溶液中的过饱和度,研究了温度、过饱和度和NaCl的添加量对Li2CO3成核诱导期的影响,并结合经典初级成核理论计算了活化能、固-液界面张力和接触角等成核动力学参数.结果显示,在相同的过饱和度下,NaCl的添加使得Li2CO3的成核诱导期增长;添加NaCl后Li2CO3成核反应的活化能从63.69 kJ/mol(溶液中Cl‒的超额含量Y=0)增加到72.85 kJ/mol(溶液中Cl‒的超额含量Y=0.5),表明NaCl的添加抑制了Li2CO3的成核.采用经典初级成核理论研究了Li2CO3的两种成核机制(均相成核和非均相成核),计算结果表明,在同一温度下,均相成核时的固-液界面张力始终大于非均相成核时的固-液界面张力,温度的变化以及NaCl的添加对固-液界面张力的影响均可忽略.
碳酸锂(Li2CO3)是锂的基础产品之一,占锂总需求量的39%以上[1],被广泛应用于电池、能源、陶瓷、冶金及医药等重要领域[2~4].随着全球新能源的不断开发以及储能锂电池的高速发展,Li2CO3因其作为锂电池生产的重要原料而备受瞩目[5~7].我国对Li2CO3的需求量逐年快速递增,预计到2025年会增加到45万吨左右[8].但是我国锂原料供应的对外依存度仍高达70%以上[9,10],因此加快推进Li2CO3的工业生产对我国的能源安全具有重要的战略意义.
我国超过71%的锂资源赋存于盐湖卤水中,而且盐湖卤水提锂具有高纯、量大、绿色及经济的优势,因此盐湖卤水提锂是目前乃至未来很长一段时间内我国重要的Li2CO3生产渠道[11,12].盐湖卤水生产Li2CO3的常用方法是向卤水LiCl中加入沉淀剂Na2CO3,从而将Li2CO3沉淀结晶出来.在结晶过程中,Li2CO3晶体的成核现象直接影响到其后续的生长过程以及最终晶体产品的质量,因此研究Li2CO3在盐湖提锂体系中的成核动力学,可为结晶过程的优化以及结晶器的设计提供重要依据.影响晶体成核的因素有温度、过饱和度、添加物或杂质的含量等[13,14].由于NaCl是盐湖卤水中的主要溶质之一,因此,研究NaCl的添加对Li2CO3成核的影响非常重要.
晶体成核动力学中涉及的一个关键参数是成核诱导期(tind),它是将成核理论和实验研究关联起来的重要桥梁[15].成核诱导期是指从溶液的过饱和建立到晶核生成所需要的时间[16,17],通常采用实验方法来测定.目前Li2CO3成核动力学的研究体系包括单一LiHCO3溶液体系和Li2SO4-Na2CO3溶液体系等[13,18],但鲜少有针对盐湖提锂体系的研究.此外,由于多元过饱和溶液中离子活度系数的数值很难确定,所以在研究晶体的成核动力学时通常用溶液浓度来估算过饱和度[19],这会导致研究结果出现较大的偏差.而由Marshall Rafal博士创建的OLI电解质与水化学物性分析软件[20]集理论模型、数据库、数据回归和应用为一体,其内嵌的基于全组分的模型能完整严格地计算多组分溶液体系中的热力学数据.
本文研究了Li2CO3在有无添加NaCl的LiCl-Na2CO3过饱和溶液中的成核动力学,其中,温度范围为288.15~323.15 K,过饱和度范围为5.76~31.73.采用具有良好稳定性和灵敏度的激光在线法[21]测量了Li2CO3的成核诱导期.溶液中Li2CO3的过饱和度由OLI电解质与水化学物性分析软件[20]内嵌的全组分热力学模型严格计算,其中,溶液中离子的活度系数由嵌入的Bromley-Zemaitis方程[22,23]来计算,热力学平衡常数由嵌入的HKF模型[24~26]来计算.系统考察了过饱和度、温度以及NaCl的添加对Li2CO3成核动力学的影响,并结合经典初级成核理论计算了活化能、固-液界面张力和接触角等成核动力学参数.
1实验部分
1.1试剂与仪器
LiCl·H2O(纯度≥99%)、Na2CO3(纯度≥99.8%)和NaCl(纯度≥99.5%),分析纯,国药集团化学试剂有限公司;去离子水(电导率<0.1μS/cm).
超微量分析天平(精确度±0.0001 g),芬兰Kibron公司;84-1A型磁力搅拌器,上海司乐仪器有限公司;激光在线监测装置,北京市东西分析仪器有限公司.
1.2实验过程
成核诱导期测定实验在一个通有循环水的玻璃夹套反应釜(容积为150 mL)中进行,釜内溶液浊度的变化通过一套激光在线装置来监测,实验装置见Scheme 1.将50 mL浓度为1.352~3.088 mol/L的LiCl溶液置于反应釜中,使用循环水将溶液温度升高或降低到某一数值.开启磁力搅拌器和激光在线监测装置,待溶液温度及激光数据采集器数值恒定后,将50 mL相同温度的Na2CO3溶液迅速加入LiCl溶液中并记录时间.激光采集器数值先是恒定一段时间不变,然后开始降低;紧接着可以观察到溶液变浑浊(Li2CO3晶核生成),而且随激光强度数值的降低越来越浑浊;当激光强度的数值不再变化时,结束实验.所记录的激光强度数值恒定不变的时间段即为Li2CO3的成核诱导期.在以上实验中,LiCl溶液的浓度均为Na2CO3溶液浓度的2倍.
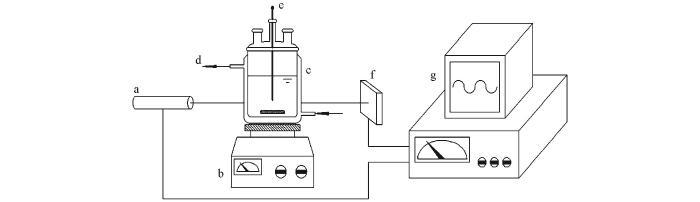
a. Laser generator; b. magnetic stirrer; c. jacketed reactor; d. circulating water; e. thermometer; f. laser detector; g. data acquisition.
在研究NaCl添加量对成核诱导期的影响实验中,将Na2CO3溶液加入反应釜以前要先加入一定质量的NaCl固体,其余的实验步骤同上.为了便于计算,将Cl‒的超额含量定义如下[27]:
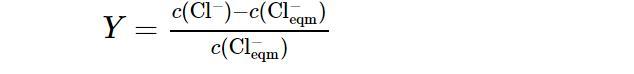
式中:c(Cl‒)(mol/L)为溶液中Cl‒的总摩尔浓度;c(Cl−eqm)(mol/L)为由于NaCl的加入而增加的Cl‒的摩尔浓度.每组实验均在Cl‒的超额含量Y=0.5的条件下进行.










