合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
-
> 温度对水—十二烷基硫酸钠体系与纯水体系界面张力、厚度的影响——模拟方法
> 镀锡板与涂料的表面张力不匹配导致印铁缩孔,怎么解决?
> 来自于液滴的表面张力的灵感,开发一种在可变的地形上移动的轮子
> 锂电池涂布工艺缺陷与表面张力有何关系?
> 基于表面张力系数等模拟液滴撞击热壁面的动力学行为(二)
> 界面流变仪可以测量液体表面张力吗?界面流变仪与界面张力仪区别解析
> 仲醇聚氧乙烯醚硫酸盐平衡和动态表面张力及应用性能研究(三)
> 表面张力仪试验原理和方法解析
> 单层膜界面上亚微米颗粒表面张力阻力系数修正——膜的性质及实验方法
> 表面张力实验、接触角实验分析抑尘试剂对煤的润湿结果
推荐新闻Info
-
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(三)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(二)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(一)
> 界面流变仪可以测量液体表面张力吗?界面流变仪与界面张力仪区别解析
> 测量表面张力/界面张力的仪器有哪些?怎么选
> PG脱酰胺添加量对玉米醇溶蛋白气-水动态表面张力的影响
> 芬兰Kibron表面张力仪使用指南【专业版】
> 平面流动皂膜表面张力系数、厚度和流动速度实验装置及测量方法(二)
> 平面流动皂膜表面张力系数、厚度和流动速度实验装置及测量方法(一)
> 单层膜界面上亚微米颗粒表面张力阻力系数修正——颗粒在单层膜上的阻力系数
Delta-8 动物胃肠道体内中药物的溶解度的测定——结果和讨论
来源:上海谓载 浏览 2581 次 发布时间:2021-11-26
结果和讨论
胃肠液的pH值和缓冲能力
表1总结了缓冲容量测定期间从解冻的胃肠液测量的胃肠液pH值。与之前的研究不同,这些pH测量值可能与原位GI pH测量值没有直接关系。[6,12]图1显示了pH值变化为0.5和1.0单位时测得的缓冲容量的比较(ΔpH)。通常可以看出,在1.0 pH单位变化下测得的缓冲容量低于在0.5单位变化下测得的缓冲容量,这是由于与仅0.5 pH单位的变化相比,产生1.0单位pH变化所需的酸或碱比例更少,因为缓冲液在pH值进一步增加或降低超过其pka时会变弱。然而,在大鼠盲肠和结肠中,1.0单位pH变化时的缓冲容量高于0.5单位pH变化时的缓冲容量(图1a);这可归因于发酵产物中存在多种缓冲物质,例如具有不同pka值的短链脂肪酸。值得注意的是,猪的体液中没有观察到这种行为(图1c),这可能是因为盲肠发酵在大鼠营养(粪噬)中比在猪中更重要。在兔液中也进行了类似的观察(图1b),平均而言,在0.5ΔpH单位下测得的缓冲容量高于在1.0ΔpH条件下测得的缓冲容量,但统计显著性(P<0.05)仅见于空肠和盲肠。
表1大鼠、兔和猪胃肠液(上清液)的pH缓冲容量、渗透压、表面张力以及美沙拉秦和泼尼松龙在这些液体中的溶解度。
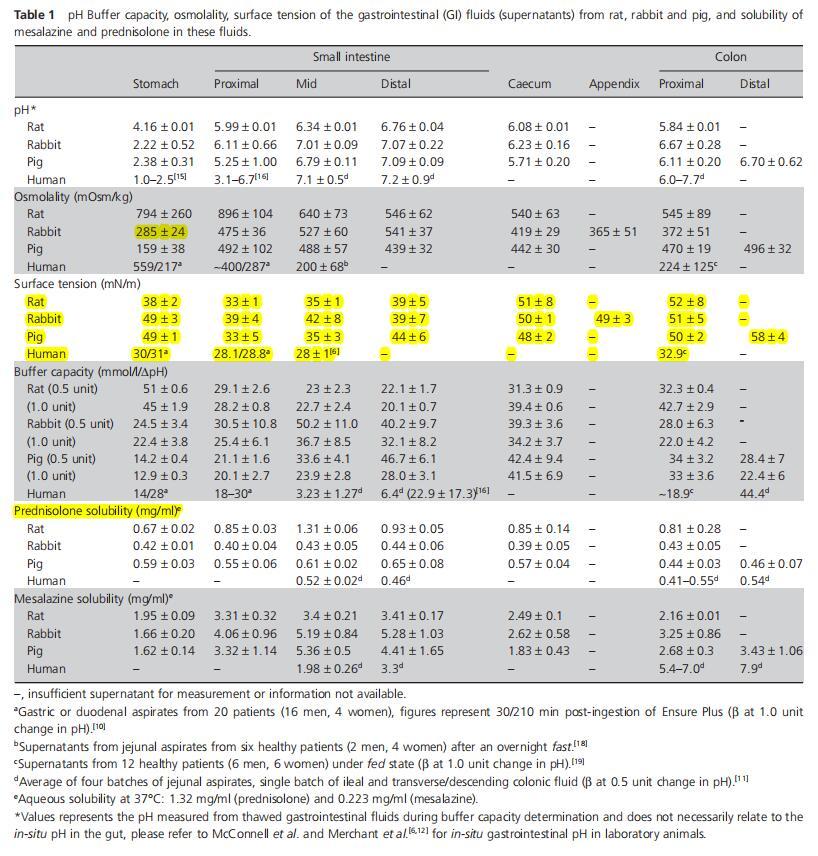
一般而言,猪和兔胃肠道的缓冲容量趋势相似(图1d)。胃的缓冲容量较低,然后小肠的缓冲容量增加(P<0.05),在中/远端小肠达到峰值。在结肠中则下降(P<0.05)。然而,在大鼠身上可以看到相反的趋势,胃液中的缓冲容量最高,小肠中的缓冲容量下降,盲肠和结肠中的缓冲容量再次增加。大鼠和猪的最高测量缓冲容量相似,但该峰值测量的GI位置不同,即胃(大鼠)和远端小肠(猪)(图1d)。
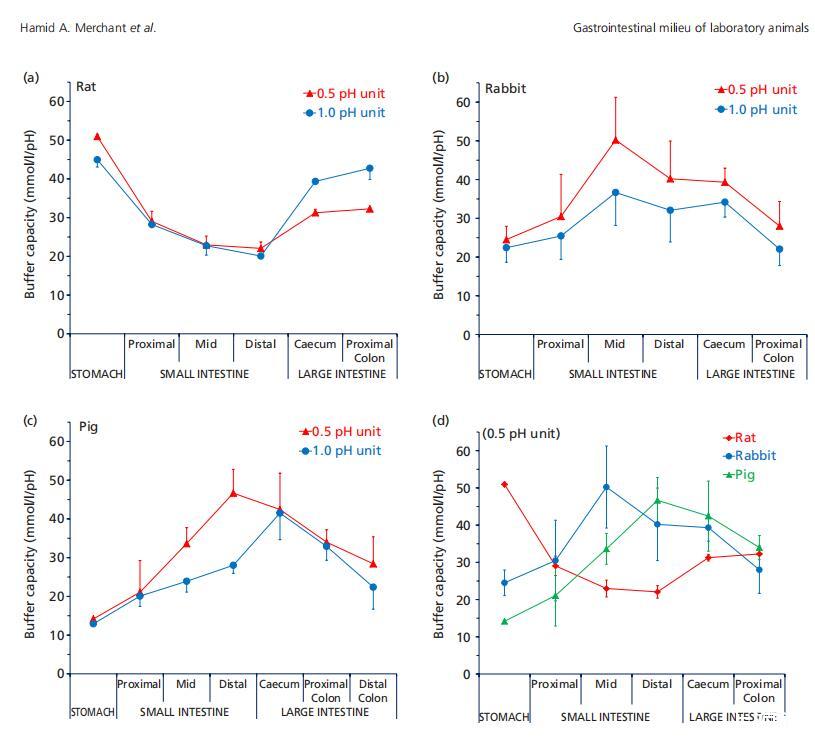
图1(a)来自大鼠(n=3),(b)兔子(n=6),(c)猪(n=3)的混合样品的胃肠液(上清液)缓冲容量(平均值±标准偏差(SD)),在pH单位变化0.5和1.0时测量,以及(d)整个胃肠道缓冲容量的种间趋势。
通过比较这些动物物种和人类物种的缓冲能力趋势,可以得出一些有趣的观察结果。据报告,人胃吸出物的缓冲容量为14 mmol/l/ΔpH,在摄入液体餐后30分钟(Sure Plus,Abbott Laboratories,Chicago,IL)增加到28 mmol/l/ΔpH,在摄入液体餐后210分钟。[10]这也与膳食本身的缓冲容量有关(Sure Plus,24 mmol/l/ΔpH)。人类摄入液态膳食30分钟后测得的缓冲容量与猪胃液中测得的缓冲容量相似,但令人惊讶的是,大鼠胃中的缓冲容量更高(表1)。在进食后30–210分钟内,十二指肠吸出物的缓冲容量在18和30 mmol/l/ΔpH之间变化,与猪、大鼠和兔近端小肠的缓冲容量相似(分别为20.1、28.2和25.4 mmol/l/ΔpH)。然而,应该记住,Kalantzi及其同事测量了整个胃和十二指肠吸出物的缓冲容量,而我们的测量是在上清液中进行的。人类空肠和回肠液[11]的缓冲容量明显低于大鼠、猪和兔子(表1)。
据报道,人类升结肠液上清液的缓冲容量约为18.9 mmol/l/ΔpH[19],显着低于猪和大鼠近端结肠的缓冲容量(分别为33和42.7 mmol/l/ΔpH),但接近兔子的缓冲容量(22.0 mmol/l/ΔpH)。 然而,当测试来自人类的整个升结肠液而不是上清液时,估计缓冲容量要高得多(几乎是两倍)(37 mmol/l/ΔpH)。 作者认为,这是由于整个结肠液中普遍存在的细菌介导反应消耗了滴定酸。 [19]这也可归因于结肠材料上的酸吸附,其在整个液体中占主导地位,而在上清液中占主导地位。 从人类远端结肠样本中测量的缓冲容量[11]几乎是猪的两倍(表1),而大鼠和兔远端结肠中的缓冲容量无法测量,因为它们各自的远端肠道中缺少液体。 然而,当测试来自人类的整个升结肠液而不是上清液时,估计缓冲容量要高得多(几乎是两倍)(37 mmol/l/ΔpH)。作者认为,这是由于整个结肠液中普遍存在的细菌介导反应消耗了滴定酸。[19]这也可归因于结肠材料上的酸吸附,其在整个液体中占主导地位,而在上清液中占主导地位。从人类远端结肠样本中测量的缓冲容量[11]几乎是猪的两倍(表1),而大鼠和兔远端结肠中的缓冲容量无法测量,因为它们各自的远端肠道中缺少液体。
胃肠液渗透压
三种动物模型的胃肠内容物的渗透压通常遵循相同的趋势,胃低,近端小肠增加,远端减少。猪似乎沿着这种模式一直到盲肠,在结肠处进一步轻微增加(图2)。然而,在大鼠中,由于胃渗透压的高度可变性,胃内容物的渗透压与近端和中端小肠的渗透压没有统计学差异。这种渗透压模式通常与消化系统的生理学相一致,在消化系统中,大多数食物在小肠中被消化并分解为葡萄糖、氨基酸和脂肪酸等组成成分,因此液体的渗透压较高。随着营养被肠道进一步吸收,内容物的渗透压降低。
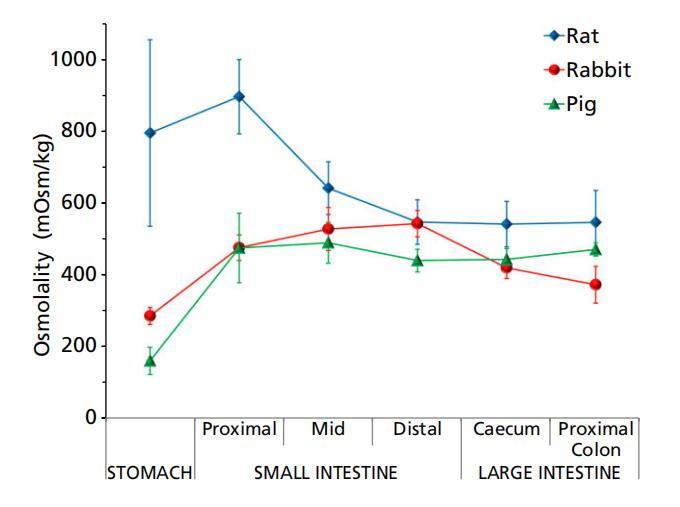
图2大鼠(n=3)、兔子(n=6)和猪(n=3)胃肠液(上清液)的渗透压(平均值±标准偏差(SD))。
在胃和近端小肠中,大鼠GI含量的渗透压显著高于兔子和猪(P<0.05)(图2,表1)。当比较大鼠和猪的液体时,仅在近端肠道(胃、近端和小肠中部)发现统计意义,其中大鼠的渗透压高于猪。家兔胃和远端小肠(回肠)的渗透压显著高于猪(P<0.05),而胃肠道其他部位的液体没有显著差异。渗透压的种间差异可能是由于这些动物的饮食不同、胃肠分泌物(酶、胆汁等)的种间差异或胃肠液中自由水与固体比率的差异。
当渗透压数据与已发表文献中的人体数据进行比较时,观察到了有趣的趋势。Kalantzi及其同事报告,在摄入液态膳食(Sure Plus)30分钟后,人类胃液的渗透压为559 mOsm/kg,高于喂养条件下兔子和猪胃液的渗透压。然而,这与大鼠的胃渗透压相似(表1)。研究还发现,研究前摄入的液体膳食的渗透压(Sure Plus,610 mOsm/kg)对人体胃液的渗透压有很大影响,因此,摄入30分钟后,胃液的渗透压(559 mOsm/kg)密切相关。进食210分钟后,可能在胃排空后,这一水平降低到217 mOsm/kg。人十二指肠吸出物的渗透压为∼400mosm/kg,相对低于大鼠、兔和猪;然而,它与猪(492±102 mOsm/kg)和兔子(475±36 mOsm/kg)相当。还应注意的是,我们在动物身上的测量是在上清液上进行的,而Kalantzi等人使用的是整个胃和十二指肠抽吸物。禁食条件下人类空肠吸出物的渗透压显著低于喂养的大鼠、兔子和猪。[18]来自人类升结肠液的上清液[19]也显示出显著低于我们在大鼠、兔子和猪中测量的渗透压(224 mOsm/kg)。
胃肠液表面张力
大鼠、兔和猪的胃肠液在整个肠道的表面张力明显低于水的表面张力。这些动物的表面张力遵循一般模式,胃的表面张力较高,小肠的表面张力较低,而远端肠道的表面张力再次升高(图3,表1)。这种表面张力的行为也与肠道内的消化过程相一致。小肠环境中的消化营养物(如葡萄糖、氨基酸、脂肪酸)和消化分泌物(如胆汁)降低了该区域液体的表面张力,然后在远端肠道中重新吸收,从而产生更高的表面张力。
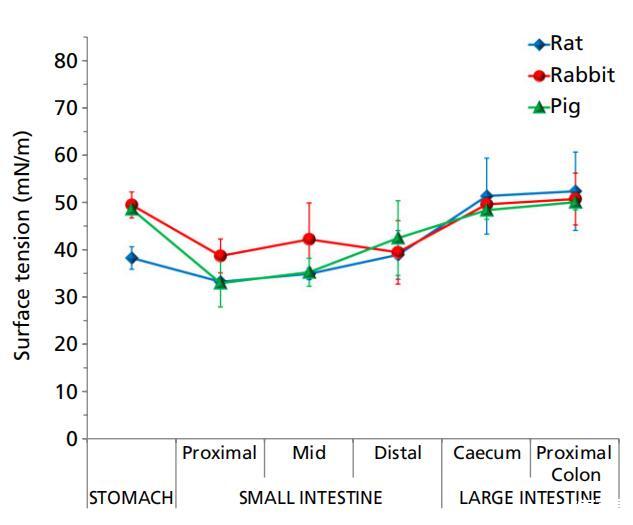
图3大鼠(n=3)、兔子(n=6)和猪(n=3)胃肠液(上清液)的表面张力(平均值±标准偏差(SD))。 以水的表面张力为基准,测得其为72.8 mN/m。
大鼠胃内容物的表面张力与小肠的表面张力无统计学差异,但显着低于盲肠和结肠(P<0.05)。 兔胃肠内容物的表面张力曲线具有特征性。 胃液的表面张力较高,近端小肠的表面张力较低(P<0.05),盲肠的表面张力显着升高(P<0.05),结肠的表面张力保持不变。 猪胃液的表面张力比兔子高; 兔胃肠内容物的表面张力曲线具有特征性。胃液的表面张力较高,近端小肠的表面张力较低(P<0.05),盲肠的表面张力显著升高(P<0.05),结肠的表面张力保持不变。猪胃液的表面张力比兔子高;然后在小肠中减少(P<0.05),在盲肠和近端结肠中增加以匹配胃水平,在远端结肠中进一步增加(P<0.05)。
文献中报道的人类胃肠道吸出物的表面张力低于我们在大鼠、兔子和猪身上的测量值。据报道,人胃吸出物的表面张力是∼30 mN/m,在一段时间内相对恒定[10],低于大鼠、兔和猪胃液的表面张力,可按如下顺序排列:人<大鼠<猪≅ 兔子类似的观察结果也见于人十二指肠抽吸物,其表面张力最低(∼28 mN/m)比动物物种(人类<大鼠≅ 猪<兔子)。如前几节所述,值得注意的是,Kalantzi及其同事测试了整个胃和十二指肠抽吸物,而我们的测量是在动物胃肠液的上清液中进行的。与大鼠、兔和猪的近端结肠液的表面张力相比,人类升结肠液上清液的表面张力也最低(32.9 mN/m)[19]。
药物在胃肠液中的溶解度
泼尼松龙的水溶性为0.223mg/ml;[11] 该值低于这些调查中观察到的值(表1)。泼尼松龙的溶解度是合理恒定的,与猪和兔肠道样本的位置无关,并且更接近于之前测量的人类空肠、回肠和结肠液体中的溶解度[11](图4)。然而,从胃到小肠中部,泼尼松龙在大鼠体内的溶解度呈上升趋势,此后,在远端小肠中的溶解度下降,但在肠道下方没有明显变化。强的松在大鼠肠道液体中的溶解度通常高于人类,但在近端结肠除外,因为近端结肠的变异性更高,所以差异没有达到统计学意义。与大鼠胃液相比,大鼠近端肠道的特殊溶解行为可能是由于近端和中段小肠的表面张力相对较低(表1)。由于泼尼松龙是一种可结合的化合物,其溶解度预计与pH无关;这与我们的研究结果是一致的。在任何受试动物物种中,泼尼松龙溶解度与缓冲容量、渗透压或表面张力之间也没有显著关系(图5)。
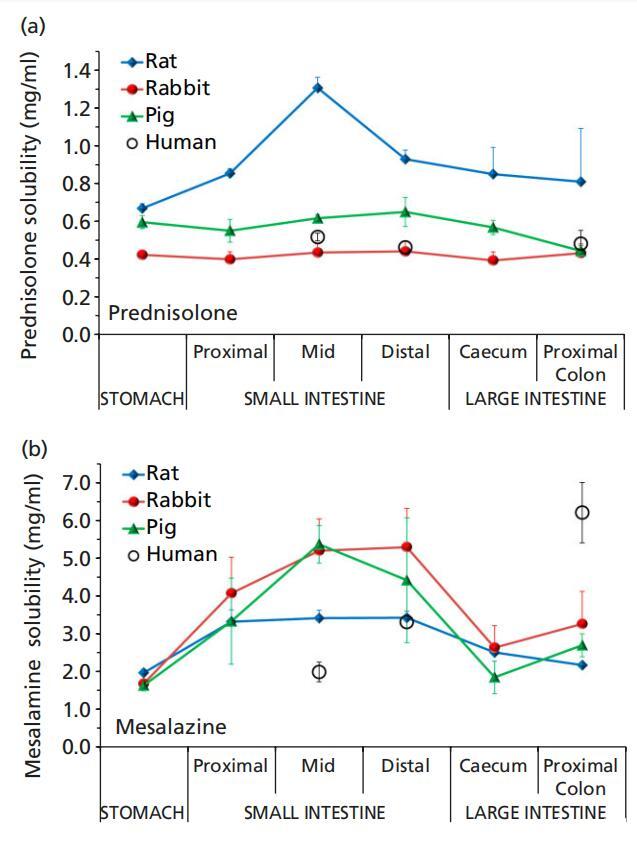
图4(a)泼尼松龙和(b)美沙拉秦在大鼠(8只大鼠)、兔子(n=6)和猪(n=3)胃肠液(上清液)中的溶解度,Fadda等人的人类数据。[11]
美沙拉秦在兔和猪胃液、小肠液、盲肠液和近端结肠液中的溶解度相当。大鼠在胃中的溶解度与兔子和猪相当,但在小肠中段的溶解度显著降低,这可能是由于猪和兔子的小肠中段的pH值和缓冲容量相对高于大鼠。报告的美沙拉秦在人体体液中的溶解度[11]仅与大鼠和猪在远端小肠中的溶解度相当,而在人类空肠吸出物中的溶解度要低得多,在人类结肠液中的溶解度要比所有三种动物中的溶解度高得多(表1,图5)。
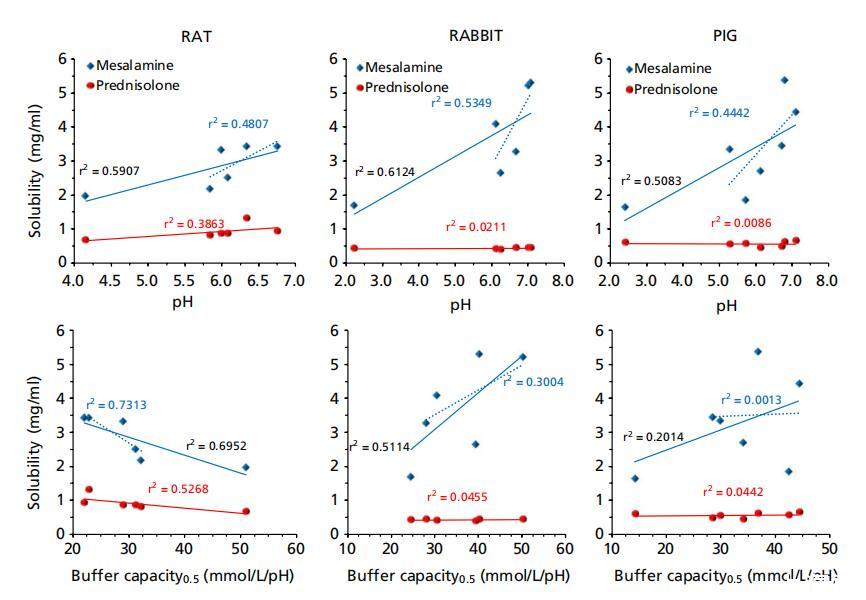
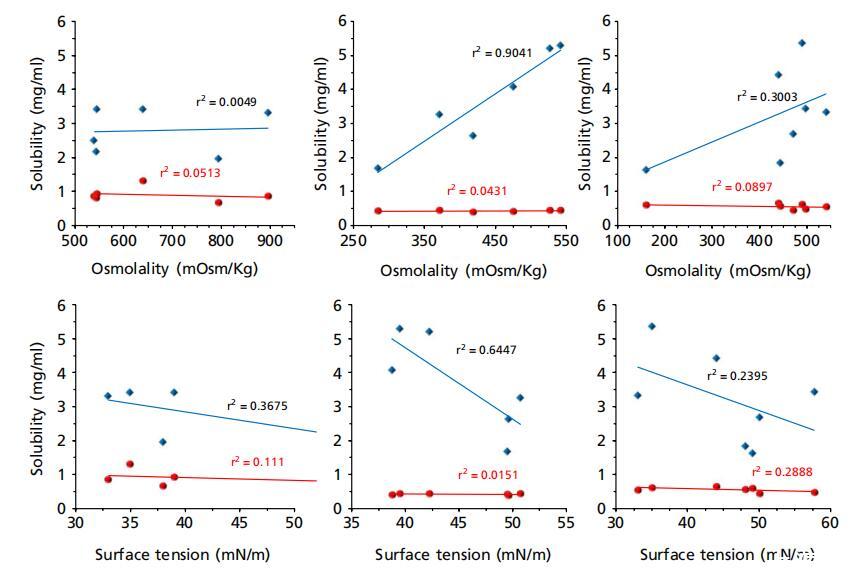
图5:美沙拉秦(蓝色钻石)和泼尼松龙(红色圆圈)在大鼠、兔和猪胃肠液(上清液)中的溶解度与其pH值、缓冲容量、渗透压和表面张力的函数关系,其中蓝色虚线表示除胃液外的美沙拉秦相关性。
当将美沙拉秦的溶解度作为pH值、缓冲容量、渗透压和表面张力的函数进行研究时,发现美沙拉秦的溶解度与大鼠和猪的GI pH值呈正相关,这与人类的类似报告一致。[11]美沙拉秦是一种具有两个可电离基团的两性离子化合物, − 酷和 − NH2(pKa 2.3,5.99[17]),因此其在不同pH值的无缓冲水中的溶解度呈现U形曲线,通过添加等分的HCl或NaOH获得,在极端酸性(pH<1)和碱性(pH>6)[17]下显示峰值,对应于两个可电离基团的pKa。 然而,在本研究中未发现这种U形行为,这可能是因为获得的胃液最低pH值大于2.0(兔子和猪),而在大鼠中大于4.0。 还应了解,与French和Mauger使用的无缓冲水相比,胃肠液中存在多种缓冲物质。[17]然而,当通过省略胃肠液基本pH范围内的胃腔(图5中的虚线)来关联pH数据时, 发现线性相关性表明,随着肠道pH值的增加,溶解度增加,这与French和Mauger发现的行为一致。[17]然而,胃肠液中的溶解度程度低于报告[17],例如肠道液中的溶解度(pH ∼ 7) 比在pH值下的无缓冲水中的报告值低三倍 ∼ 6.5.
然而,对于清管器液体,与缓冲容量的相关性非常弱(对于ΔpH=0.5:标准化系数β=0.349,P=0.442;r2=0.201)。 但是,发现大鼠的体液具有非常强的相关性(ΔpH=0.5:标准化系数β),尽管呈负相关= 这可以通过大鼠胃液的缓冲容量显着增加和大鼠胃液中缓冲容量的典型下降趋势来解释,表明pH值是可电离药物美沙拉秦溶解度的相对更重要的驱动因素。 在兔子的胃肠液中,美沙拉秦溶解度与渗透压(标准化系数β=0.951,P=0.004;r2=0.904)和pH(标准化系数β=0.783,P=0.066;r2=0.612)的相关性更强,而与缓冲容量无关 这与Fadda等人[11]的发现相反,后者报告了与缓冲容量的更强相关性。 但是,发现大鼠的体液具有非常强的相关性(ΔpH=0.5:标准化系数β),尽管呈负相关=−0.835,P=0.039;r2=0.695/对于ΔpH=1.0:标准化系数β=−0.997,P=0.001;r2=0.955)(图5),与人体体液相反,[11]其中pH值和缓冲容量均呈正相关。这可以通过大鼠胃液的缓冲容量显著增加和大鼠胃液中缓冲容量的典型下降趋势来解释,表明pH值是可电离药物美沙拉秦溶解度的相对更重要的驱动因素。在兔子的胃肠液中,美沙拉秦溶解度与渗透压(标准化系数β=0.951,P=0.004;r2=0.904)和pH(标准化系数β=0.783,P=0.066;r2=0.612)的相关性更强,而与缓冲容量无关(对于ΔpH=0.5:标准化系数β=0.716,P=0.109;r2=0.511/对于ΔpH=1.0:标准化系数β=0.571,P=0.236;r2=0.325)。这与Fadda等人[11]的发现相反,后者报告了与缓冲容量的更强相关性。
需要注意的是,Fadda等人[11]报告了使用体液的相关性 未考虑胃液中的溶解度,这在此处介绍的动物液中的相关性中得到了解释。有趣的是,在排除动物液中的胃溶解度后,人和动物液中的相关性变得相似(图5中的虚线) 此外,尽管区域pH值和缓冲容量较高,但猪远端小肠的平均溶解度并不高于中小肠(表1),这可以通过该区域较高的表面张力(44±6 vs.35±3)来解释 表面张力与美沙拉秦在兔子体内的溶解度之间存在一定的亲和力(标准化系数β)= − 0.802,P=0.055;r2=0.643)。需要注意的是,用于产生这些相关性的pH值对应于液体上清液中的测量值,这不一定与肠道中的原位pH值相关。
Delta-8 动物胃肠道体内中药物的溶解度的测定——摘要、介绍
Delta-8 动物胃肠道体内中药物的溶解度的测定——材料和方法










